2020年光遗传学研究进展及其展望
来源:本站原创 2020-12-31 22:19
2020年12月31日讯/生物谷BIOON/---2001年,英国牛津大学生理学教授Gero Miesenbck在世界上开创了一种叫做光遗传学的技术:通过基因改造神经细胞,让神经细胞拥表达对光产生反应的蛋白,从而成功地通过光经过基因改造的神经细胞,触发它们的电活动,这意味着可以用光控制神经细胞的电活动。作为光遗传学创始人,他也是世界上第一个通过基因改造神经细
2020年12月31日讯/生物谷BIOON/---2001年,英国牛津大学生理学教授Gero Miesenbck在世界上开创了一种叫做光遗传学的技术:通过基因改造神经细胞,让神经细胞拥表达对光产生反应的蛋白,从而成功地通过光经过基因改造的神经细胞,触发它们的电活动,这意味着可以用光控制神经细胞的电活动。作为光遗传学创始人,他也是世界上第一个通过基因改造神经细胞的科学家。此后,他对大脑中含有光响应神经细的饲养型动物进行了类似的基因改造,并且首次证明这些动物的行为可以被远程控制。Miesenbck也因此获得2020年度邵逸夫生命科学与医学奖。
光遗传学(optogenetics)是近几年正在迅速发展的一项整合了光学、软件控制、基因操作技术、电生理等多学科交叉的生物工程技术。其主要原理是首先采用基因操作技术将光敏感基因(如ChR2,eBR,NaHR3.0,Arch或OptoXR等)转入到神经系统中特定类型的细胞中进行特殊离子通道或GPCR的表达。光感离子通道在不同波长的光照刺激下会分别对阳离子或者阴离子的通过产生选择性,从而造成细胞膜两边的膜电位发生变化,达到对细胞选择性地兴奋或者抑制的目的。
光遗传技术具有独特的高时空分辨率和细胞类型特异性两大特点,克服了传统手段控制细胞或有机体活动的许多缺点,能对神经元进行非侵入式的精准定位刺激操作而彻底改变了神经科学领域的研究状况,为神经科学提供了革命性的研究手段。光遗传技术在将来还有可能发展出一系列中枢神经系统疾病的新疗法。
光遗传学技术的应用研究领域涵盖多个经典实验动物种系(果蝇、线虫、小鼠、大鼠、绒猴以及食蟹猴等),并涉及神经科学研究的多个方面,包括神经环路基础研究、学习记忆研究、成瘾性研究、运动障碍、睡眠障碍、帕金森症模型、抑郁症和焦虑症动物模型等应用。
2020年即将结束,小编针对2020年光遗传学领域取得的进展,进行一番梳理,以飨读者。
1.利用光遗传学探究神经生物学行为
2020年12月,Ee-Lynn Yap等人将小鼠暴露于新环境中,并观察了海马体的主要细胞。他们发现,接触新事物后,相对稀疏的神经元群体表达了Fos。接下来,他们阻止了这些神经元表达Fos,而其他细胞则不受影响。他们研究了表达Fos的神经元与未表达Fos的神经元之间的差异。他们使用光遗传学来打开或关闭来自附近不同神经元的输入,他们发现表达Fos的神经元的活性受两种类型的中间神经元的影响最大。

大脑中不同的神经活动模式控制着睡眠-觉醒周期。然而,这种活动如何有助于睡眠稳态,在很大程度上仍然是未知数。基底前脑中的腺苷是睡眠稳态的重要生理介质。Peng等人利用一种新开发的指标,监测了小鼠基底前脑中的腺苷浓度。它的浓度与觉醒状态和REM睡眠有明显的相关性。腺苷的活动依赖性释放也可以在光遗传刺激基底前脑谷氨酸能神经元而非胆碱能神经元后引起。这些发现为了解觉醒期间神经元活动如何通过释放睡眠诱导因子促进睡眠压力提供了新的见解。
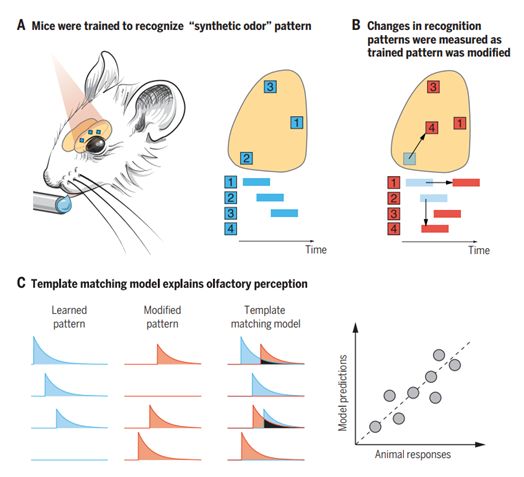
2020年6月,Edmund Chong等人对OMP-ChR2-YFP转基因杂合子小鼠(实验组)和B6(Cg)-Tyrc2J/J (albino B6)小鼠(对照组)进行了光遗传学技术操作,从而控制小鼠嗅小球在空间和时间上的神经元活动。这些小鼠经训练后识别一种可能被感知为特定气味的学习活动模式。然后,这些作者通过改变激活的嗅小球或嗅小球激活之间的时间来系统地改变活动模式,以评估它们对气味识别的影响。在合成气味早期被激活的嗅小球比随后激活的嗅小球对气味识别的贡献更大。这种方法使得神经科学能够解释特征是如何以复杂的模式组合在一起来产生感知的。
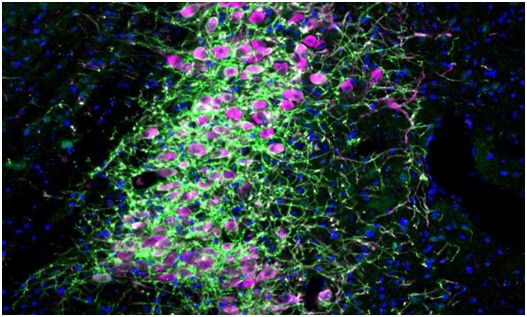
2020年12月,Sara Mederos等人发现,星形胶质细胞中GABA受体(GABABRs)亚型的遗传剔除或能改变皮质神经元的特异性振荡γ活性和放电特性。γ振荡/节律是大型神经元群体同步活动的一种形式,该过程主要参与到了机体感知、工作记忆和其它认知功能中,正如此前研究人员研究所得到的结果那样,在适应性的关键行为过程中,γ振荡参与到了神经处理过程的动态参与过程中。利用光遗传学技术(一种光诱导的细胞激活技术)来激活前额叶中的星形胶质细胞就能诱发皮质抑制性突触传递的增强、局部神经元的激活、γ振荡并能改善机体的认知表现;值得注意的是,携带剔除了GABABRs的星形胶质细胞的小鼠的工作记忆缺陷能通过光遗传学技术刺激激活的星形胶质细胞来得到弥补。
2020年5月,Yanlin He等人发现葡萄糖激发的神经元亚群使用KATP离子通道来应对葡萄糖水平,而葡萄糖抑制的神经元亚群使用另一个称为Ano4的离子通道来加以应对。他们还鉴定出葡萄糖激发和葡萄糖抑制的神经元对低血糖水平作出反应时所涉及的神经回路。他们利用光遗传学来激活小鼠中的特定神经回路,发现当葡萄糖抑制的神经元对低葡萄糖水平作出反应时,它们会激活特定的回路,结果导致血糖升高;另一方面,当葡萄糖激发的神经元对低血糖作出反应时,它们抑制了不同的回路,但结果也导致血糖水平升高。
2020年11月,Andrea Bari等人通过利用光遗传学技术特异性地控制小鼠大脑蓝斑核(locus coeruleus, LC)中的去甲肾上腺素能神经元,发现这些神经元通过靶向前额皮质的两个不同区域来控制它们执行注意力控制任务所需的两种能力:阻挡分心的专注性和抑制冲动的自律性。这些研究结果将对更好地理解和治疗精神疾病做出重要贡献。
2.优化利用光遗传学技术
2020年4月,Xin Gong等人开发一种对光敏感的称为SOUL的新型视蛋白,这种新型视蛋白即使被植入组织深处的细胞,它也能对外部光刺激做出反应。在小鼠和猕猴身上的实验表明,在头骨或大脑表面发出蓝光足以激活六毫米深的表达SOUL的神经元。这一进展将有助于扩大光遗传学在非人类灵长类动物模型中的应用,并使该技术更接近于临床应用于人类。
2020年6月,Rocio Ochoa-Fernandez等人开发出一种在环境光下可逆地控制植物中基因表达的光遗传学工具,即植物可用的光开关元件(plant usable light-switch element, PULSE)。PULSE将蓝光调节抑制因子和红光诱导的开关组合在一起。基因表达仅在红光下被激活,而在白光下或在黑暗中不进行基因表达。在定量数学模型的支持下,他们在原生质体中进行了PULSE,实现了较高的诱导率,此外,将PULSE与基于CRISPR-Cas9的技术相结合,靶向合成信号和发育途径。他们利用PULSE控制植物叶片中的免疫反应并产生了拟南芥转基因植物。
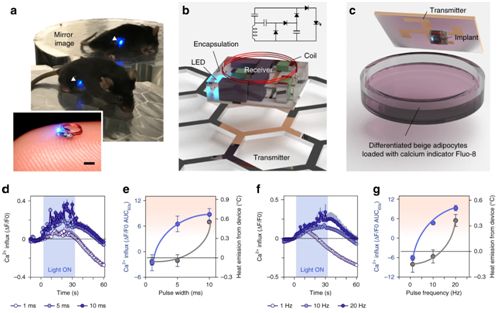
冷刺激激活的β-肾上腺素能受体(β-AR)会高效刺激脂肪组织的生热作用并增加全身能量消耗。β-AR激动剂作为一种能刺激脂肪组织产热的减肥药物,已获得了大量的研究。然而,对β-AR途径进行全身激活会导致血压增加。因此,为了在不受外部刺激的严格时空控制下促进脂肪生热, Kazuki Tajima等人于2020年4月开发出一种可植入的无线光遗传学设备,该设备绕过β-AR途径并选择性触发脂肪细胞中的钙离子循环,增加体内的能量消耗。光诱导的脂肪生热足以保护小鼠免受饮食诱导的体重增加。
2020年10月,Yingying Zhang等人将应力发光材料(掺杂镧系元素的CaZnOS晶体)和磁棒结合,构建了非植入式和植入式“磁-力发光”微器件,并以此微器件及操作系统为基础开展了不同深度组织中光遗传蛋白的调控研究,包括浅表肿瘤的光动力治疗和小鼠的神经调节。他们发现非植入式“磁-力发光”微器件刺激表达有光遗传蛋白(KillerRed)的肿瘤细胞产生大量活性氧,用于抑制皮下肿瘤的生长。植入式“磁-力发光”微器件刺激表达有光遗传蛋白(C1V1)的大鼠初级运动皮层,用于自由移动大鼠的行为学研究。
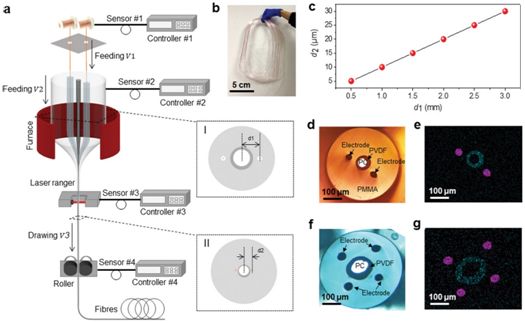
2020年6月,Minghui Du等人开发出一种多模态光纤探针技术,在单细胞水平上成功地实现了长时间(持续10周以上)和宽频率(1-20 Hz)稳定的光刺激与神经信号记录功能。这种新型光纤探针具有极佳的机械性能、光学透过性能和电学性能,以及良好的生物相容性。这种新型光纤探针有利于光遗传技术的推广应用。
3.基于光遗传学的脑接口
2020年1月,Bowen Ji等人开发出基于光遗传技术的可拉伸光电集成脑机接口MEMS器件,该器件具有高度柔性和一定程度的可拉伸性,能够自适应脑组织形变或微动,可有效避免脑组织机械损伤,同时引入蛇形金属屏蔽结构,可有效抑制集成的微型LED芯片诱发伪迹和环境电磁干扰。该器件可长期可靠植入,匹配脑组织机械刚度和提供高精度同步光刺激和电记录,在多种类型神经接口上具有广泛的应用潜力。
2020年3月,Lihui Lu等人通过结合光纤记录和光遗传学激活技术构建出一种新型光学脑-脑接口(optical brain-to-brain interface),在两只小鼠之间成功地实现了高速率的运动信息传递,从原理上验证了脑-脑接口有潜力跨个体精确控制动物运动。这种光学脑-脑接口可可稳定记录有相似功能的特定细胞类型的神经元活性,信噪比高,相对容易操作,而且避开多通道记录的技术挑战,降低了神经信息解码难度。
4.光遗传学在疾病治疗上的潜在应用
2020年6月,Hidenori Watanabe等人开发了一种腺相关病毒载体,可有效表达光敏蛋白通道视紫红质。他们将这种病毒载体精确注入控制手臂运动的猕猴大脑皮层相关区域,此前研究表明电刺激该区域可引起明显的手臂运动。他们还开发了一种光极,可以记录神经元活动并分别施加光和电刺激。通过光极的光刺激可以有效激活表达通道视紫红质的神经元,并诱导肌肉活动和手臂运动。这些结果为非人类灵长类动物的光遗传学研究以及向人类患者的临床应用(例如光学深部脑刺激)敞开了大门。
亨廷顿舞蹈病是一种遗传性神经退行性疾病,其特征是由于大脑纹状体核中神经元的变性导致运动,认知缺陷和精神疾病的改变。2020年10月,Sara Fernández-García等人使用光遗传学技术,结合电生理学和微透析技术,发现患有亨廷顿舞蹈病小鼠模型中的M2-DLS神经回路释放了的谷氨酸水平有所降低。他们随后再次使用光遗传学来反复增强改变后的M2-DLS神经回路,结果表明,这种刺激改善了这种小鼠模型的症状。
2020年12月,Lucas A Hartsough等人开发出一种利用光遗传学直接控制生活在秀丽隐杆线虫肠道中的细菌的基因表达和代谢产物产生的方法。他们对大肠杆菌进行了基因改造,使之在绿光下产生促进寿命的化合物荚膜异多糖酸,并在红光下关闭它的产生。他们发现,将绿光照射在携带经过基因改造后的大肠杆菌的透明线虫上,可以诱导大肠杆菌产生荚膜异多糖酸,从而保护线虫的肠道细胞免受应激引起的线粒体断裂的影响,从而延长这种线虫的寿命。
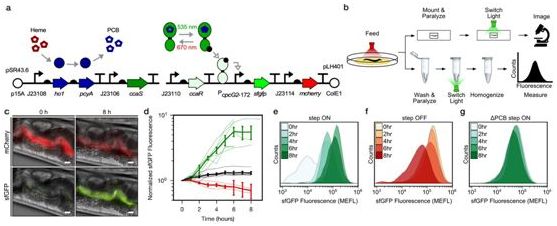
5.光遗传学在基因组编辑上的潜在应用
2020年6月,Yuanhuan Yu等人成功研发出新型的光控基因编辑系统——分割型split-Cas9(far-red light-activated split-Cas9,简称FAST系统)。他们利用特定LED光源发出的波长730 nm的远红光激活FAST系统。在异种移植肿瘤模型小鼠A549中,他们将FAST系统递送至小鼠体内的肿瘤中,然后在LED远红光的照射下,切割肿瘤致癌基因PLK1。实验结果显示,这能够显著抑制肿瘤生长。
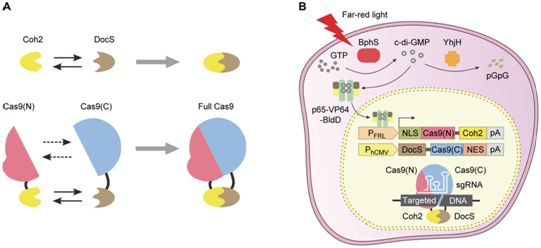
5.小结
当前,在光遗传学技术的使用过程中,科学家们首先要寻找寻合适的光敏蛋白;其次进行相应的遗传信息传递,即通过转染、病毒转导、转基因动物系的建立等方法将光敏蛋白的遗传信息传递给目标细胞;随后科学家们利用可控性演示,通过从时间和空间上控制演示光线的特定性,来实现对细胞活动的精确演示;最后对研究结果进行读取,这一过程研究者可以采用电极通过检测细胞膜内外电压来测量光敏蛋白的荧光效果变化,并可用荧光性生物传感器来检测不同细胞的读出值,进而通过行为测试来评估调整细胞活动对整个动物的影响。
在这个过程中,科学家们应当精确光刺激只会激活或抑制表达了光敏蛋白的神经元,而不能影响其他的神经元。然而,2019年6月,Scott F. Owen等人发现实验中常用的光遗传调控光照强度会引起局部脑组织0.2~2℃的升温,这种光热效应会抑制神经元的放电。这意味着在实际的研究中,应当选择合适的光刺激参数,并且在解释实验结果时应当考虑到光热效应对神经元放电的影响。
除此之外,一些科学家们认为光遗传调控光照强度有可能让神经元放电超出生理范围,这会导致神经回路会出现非生理性的活动模式,从而导致错误的生理学结论。再者,光敏蛋白的表达和光照在神经元群体中并不均匀,从而导致光遗传学操纵的量级和范围会出现异质性。此外,光刺激的位点不同也可能对光遗传学实验的结果产生不同的影响。
目前光遗传学主要是作为一种研究工具,还不能直接用于人类的疾病诊断,但是随着这种技术的不断成熟,它在神经生物学和临床医学等领域的应用将会变得越来越广泛。(生物谷 Bioon.com)
参考资料:
1.Ee-Lynn Yap et al. Bidirectional perisomatic inhibitory plasticity of a Fos neuronal network. Nature, 2020, doi:10.1038/s41586-020-3031-0.
2.Wanling Peng et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science, 2020, doi:10.1126/science.abb0556.
3.Edmund Chong et al. Manipulating synthetic optogenetic odors reveals the coding logic of olfactory perception. Science, 2020, doi:10.1126/science.aba2357.
4.Sara Medero et al. GABAergic signaling to astrocytes in the prefrontal cortex sustains goal-directed behaviors. Nature Neuroscience, 2020, doi:10.1038/s41593-020-00752-x.
5.Xin Gong et al. An ultra-sensitive step-function opsin for minimally invasive optogenetic stimulation in mice and macaques. Neuron, 2020, doi:10.1016/j.neuron.2020.03.032.
6.Andrea Bari et al. Differential attentional control mechanisms by two distinct noradrenergic coeruleo-frontal cortical pathways. PNAS, 2020, doi:10.1073/pnas.2015635117.
7.Hidenori Watanabe et al. Forelimb movements evoked by optogenetic stimulation of the macaque motor cortex. Nature Communications, 2020, doi:10.1038/s41467-020-16883-5.
8.Yanlin He et al. Estrogen receptor-α expressing neurons in the ventrolateral VMH regulate glucose balance. Nature Communications, 2020, doi:10.1038/s41467-020-15982-7.
9. Lucas A Hartsough et al. Optogenetic control of gut bacterial metabolism to promote longevity. eLife, 2020, doi:10.7554/eLife.56849.
10.Sara Fernández-García et al. M2 cortex-dorsolateral striatum stimulation reverses motor symptoms and synaptic deficits in Huntington's disease. eLife, 2020, doi:10.7554/eLife.57017.
11.Rocio Ochoa-Fernandez et al. Optogenetic control of gene expression in plants in the presence of ambient white light. Nature Methods, 2020, doi:10.1038/s41592-020-0868-y.
12.Kazuki Tajima et al. Wireless optogenetics protects against obesity via stimulation of non-canonical fat thermogenesis. Nature Communications, 2020, doi:10.1038/s41467-020-15589-y.
13.Bowen Ji et al. Flexible and stretchable opto-electric neural interface for low-noise electrocorticogram recordings and neuromodulation in vivo. Biosensors and Bioelectronics, 2020, doi:10.1016/j.bios.2020.112009.
14.Yingying Zhang et al. Remote Regulation of Optogenetic Proteins by a Magneto-Luminescence Microdevice. Advanced Functional Materials, 2020, doi:10.1002/adfm.202006357.
15.Minghui Du et al. Flexible Fiber Probe for Efficient Neural Stimulation and Detection. Advanced Science, 2020, doi:10.1002/advs.202001410.
16.Lihui Lu et al. An optical brain-to-brain interface supports rapid information transmission for precise locomotion control. Science China Life Sciences, 2020, doi:10.1007/s11427-020-1675-x.
17.Yuanhuan Yu et al. Engineering a far-red light–activated split-Cas9 system for remote-controlled genome editing of internal organs and tumors. Science Advances, 2020, doi:10.1126/sciadv.abb1777.
18.Scott F. Owen et al. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience, 2019, doi:10.1038/s41593-019-0422-3.
19.邴杰. 光遗传学技术在神经生物学领域的发展及应用. 生物学通报[J]. 2014, 49(11):5-7.
20.Scott F. Owen et al. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience, 2019, doi:10.1038/s41593-019-0422-3.
21.Michael Häusser. Optogenetics: the age of light. Nature Methods, 2014, doi:10.1038/nmeth.3111.
光遗传学(optogenetics)是近几年正在迅速发展的一项整合了光学、软件控制、基因操作技术、电生理等多学科交叉的生物工程技术。其主要原理是首先采用基因操作技术将光敏感基因(如ChR2,eBR,NaHR3.0,Arch或OptoXR等)转入到神经系统中特定类型的细胞中进行特殊离子通道或GPCR的表达。光感离子通道在不同波长的光照刺激下会分别对阳离子或者阴离子的通过产生选择性,从而造成细胞膜两边的膜电位发生变化,达到对细胞选择性地兴奋或者抑制的目的。
光遗传技术具有独特的高时空分辨率和细胞类型特异性两大特点,克服了传统手段控制细胞或有机体活动的许多缺点,能对神经元进行非侵入式的精准定位刺激操作而彻底改变了神经科学领域的研究状况,为神经科学提供了革命性的研究手段。光遗传技术在将来还有可能发展出一系列中枢神经系统疾病的新疗法。
光遗传学技术的应用研究领域涵盖多个经典实验动物种系(果蝇、线虫、小鼠、大鼠、绒猴以及食蟹猴等),并涉及神经科学研究的多个方面,包括神经环路基础研究、学习记忆研究、成瘾性研究、运动障碍、睡眠障碍、帕金森症模型、抑郁症和焦虑症动物模型等应用。
2020年即将结束,小编针对2020年光遗传学领域取得的进展,进行一番梳理,以飨读者。
1.利用光遗传学探究神经生物学行为
2020年12月,Ee-Lynn Yap等人将小鼠暴露于新环境中,并观察了海马体的主要细胞。他们发现,接触新事物后,相对稀疏的神经元群体表达了Fos。接下来,他们阻止了这些神经元表达Fos,而其他细胞则不受影响。他们研究了表达Fos的神经元与未表达Fos的神经元之间的差异。他们使用光遗传学来打开或关闭来自附近不同神经元的输入,他们发现表达Fos的神经元的活性受两种类型的中间神经元的影响最大。

图片来自Public Domain。
大脑中不同的神经活动模式控制着睡眠-觉醒周期。然而,这种活动如何有助于睡眠稳态,在很大程度上仍然是未知数。基底前脑中的腺苷是睡眠稳态的重要生理介质。Peng等人利用一种新开发的指标,监测了小鼠基底前脑中的腺苷浓度。它的浓度与觉醒状态和REM睡眠有明显的相关性。腺苷的活动依赖性释放也可以在光遗传刺激基底前脑谷氨酸能神经元而非胆碱能神经元后引起。这些发现为了解觉醒期间神经元活动如何通过释放睡眠诱导因子促进睡眠压力提供了新的见解。
2020年6月,Edmund Chong等人对OMP-ChR2-YFP转基因杂合子小鼠(实验组)和B6(Cg)-Tyrc2J/J (albino B6)小鼠(对照组)进行了光遗传学技术操作,从而控制小鼠嗅小球在空间和时间上的神经元活动。这些小鼠经训练后识别一种可能被感知为特定气味的学习活动模式。然后,这些作者通过改变激活的嗅小球或嗅小球激活之间的时间来系统地改变活动模式,以评估它们对气味识别的影响。在合成气味早期被激活的嗅小球比随后激活的嗅小球对气味识别的贡献更大。这种方法使得神经科学能够解释特征是如何以复杂的模式组合在一起来产生感知的。

图片来自Science, 2020, doi:10.1126/science.aba2357。
2020年12月,Sara Mederos等人发现,星形胶质细胞中GABA受体(GABABRs)亚型的遗传剔除或能改变皮质神经元的特异性振荡γ活性和放电特性。γ振荡/节律是大型神经元群体同步活动的一种形式,该过程主要参与到了机体感知、工作记忆和其它认知功能中,正如此前研究人员研究所得到的结果那样,在适应性的关键行为过程中,γ振荡参与到了神经处理过程的动态参与过程中。利用光遗传学技术(一种光诱导的细胞激活技术)来激活前额叶中的星形胶质细胞就能诱发皮质抑制性突触传递的增强、局部神经元的激活、γ振荡并能改善机体的认知表现;值得注意的是,携带剔除了GABABRs的星形胶质细胞的小鼠的工作记忆缺陷能通过光遗传学技术刺激激活的星形胶质细胞来得到弥补。
2020年5月,Yanlin He等人发现葡萄糖激发的神经元亚群使用KATP离子通道来应对葡萄糖水平,而葡萄糖抑制的神经元亚群使用另一个称为Ano4的离子通道来加以应对。他们还鉴定出葡萄糖激发和葡萄糖抑制的神经元对低血糖水平作出反应时所涉及的神经回路。他们利用光遗传学来激活小鼠中的特定神经回路,发现当葡萄糖抑制的神经元对低葡萄糖水平作出反应时,它们会激活特定的回路,结果导致血糖升高;另一方面,当葡萄糖激发的神经元对低血糖作出反应时,它们抑制了不同的回路,但结果也导致血糖水平升高。
2020年11月,Andrea Bari等人通过利用光遗传学技术特异性地控制小鼠大脑蓝斑核(locus coeruleus, LC)中的去甲肾上腺素能神经元,发现这些神经元通过靶向前额皮质的两个不同区域来控制它们执行注意力控制任务所需的两种能力:阻挡分心的专注性和抑制冲动的自律性。这些研究结果将对更好地理解和治疗精神疾病做出重要贡献。

图片来自PNAS, 2020, doi:10.1073/pnas.2015635117。
2.优化利用光遗传学技术
2020年4月,Xin Gong等人开发一种对光敏感的称为SOUL的新型视蛋白,这种新型视蛋白即使被植入组织深处的细胞,它也能对外部光刺激做出反应。在小鼠和猕猴身上的实验表明,在头骨或大脑表面发出蓝光足以激活六毫米深的表达SOUL的神经元。这一进展将有助于扩大光遗传学在非人类灵长类动物模型中的应用,并使该技术更接近于临床应用于人类。
2020年6月,Rocio Ochoa-Fernandez等人开发出一种在环境光下可逆地控制植物中基因表达的光遗传学工具,即植物可用的光开关元件(plant usable light-switch element, PULSE)。PULSE将蓝光调节抑制因子和红光诱导的开关组合在一起。基因表达仅在红光下被激活,而在白光下或在黑暗中不进行基因表达。在定量数学模型的支持下,他们在原生质体中进行了PULSE,实现了较高的诱导率,此外,将PULSE与基于CRISPR-Cas9的技术相结合,靶向合成信号和发育途径。他们利用PULSE控制植物叶片中的免疫反应并产生了拟南芥转基因植物。
冷刺激激活的β-肾上腺素能受体(β-AR)会高效刺激脂肪组织的生热作用并增加全身能量消耗。β-AR激动剂作为一种能刺激脂肪组织产热的减肥药物,已获得了大量的研究。然而,对β-AR途径进行全身激活会导致血压增加。因此,为了在不受外部刺激的严格时空控制下促进脂肪生热, Kazuki Tajima等人于2020年4月开发出一种可植入的无线光遗传学设备,该设备绕过β-AR途径并选择性触发脂肪细胞中的钙离子循环,增加体内的能量消耗。光诱导的脂肪生热足以保护小鼠免受饮食诱导的体重增加。

图片来自Nature Communications, 2020, doi:10.1038/s41467-020-15589-y。
2020年10月,Yingying Zhang等人将应力发光材料(掺杂镧系元素的CaZnOS晶体)和磁棒结合,构建了非植入式和植入式“磁-力发光”微器件,并以此微器件及操作系统为基础开展了不同深度组织中光遗传蛋白的调控研究,包括浅表肿瘤的光动力治疗和小鼠的神经调节。他们发现非植入式“磁-力发光”微器件刺激表达有光遗传蛋白(KillerRed)的肿瘤细胞产生大量活性氧,用于抑制皮下肿瘤的生长。植入式“磁-力发光”微器件刺激表达有光遗传蛋白(C1V1)的大鼠初级运动皮层,用于自由移动大鼠的行为学研究。
2020年6月,Minghui Du等人开发出一种多模态光纤探针技术,在单细胞水平上成功地实现了长时间(持续10周以上)和宽频率(1-20 Hz)稳定的光刺激与神经信号记录功能。这种新型光纤探针具有极佳的机械性能、光学透过性能和电学性能,以及良好的生物相容性。这种新型光纤探针有利于光遗传技术的推广应用。

图片来自Advanced Science, 2020, doi:10.1002/advs.202001410。
3.基于光遗传学的脑接口
2020年1月,Bowen Ji等人开发出基于光遗传技术的可拉伸光电集成脑机接口MEMS器件,该器件具有高度柔性和一定程度的可拉伸性,能够自适应脑组织形变或微动,可有效避免脑组织机械损伤,同时引入蛇形金属屏蔽结构,可有效抑制集成的微型LED芯片诱发伪迹和环境电磁干扰。该器件可长期可靠植入,匹配脑组织机械刚度和提供高精度同步光刺激和电记录,在多种类型神经接口上具有广泛的应用潜力。
2020年3月,Lihui Lu等人通过结合光纤记录和光遗传学激活技术构建出一种新型光学脑-脑接口(optical brain-to-brain interface),在两只小鼠之间成功地实现了高速率的运动信息传递,从原理上验证了脑-脑接口有潜力跨个体精确控制动物运动。这种光学脑-脑接口可可稳定记录有相似功能的特定细胞类型的神经元活性,信噪比高,相对容易操作,而且避开多通道记录的技术挑战,降低了神经信息解码难度。
4.光遗传学在疾病治疗上的潜在应用
2020年6月,Hidenori Watanabe等人开发了一种腺相关病毒载体,可有效表达光敏蛋白通道视紫红质。他们将这种病毒载体精确注入控制手臂运动的猕猴大脑皮层相关区域,此前研究表明电刺激该区域可引起明显的手臂运动。他们还开发了一种光极,可以记录神经元活动并分别施加光和电刺激。通过光极的光刺激可以有效激活表达通道视紫红质的神经元,并诱导肌肉活动和手臂运动。这些结果为非人类灵长类动物的光遗传学研究以及向人类患者的临床应用(例如光学深部脑刺激)敞开了大门。
亨廷顿舞蹈病是一种遗传性神经退行性疾病,其特征是由于大脑纹状体核中神经元的变性导致运动,认知缺陷和精神疾病的改变。2020年10月,Sara Fernández-García等人使用光遗传学技术,结合电生理学和微透析技术,发现患有亨廷顿舞蹈病小鼠模型中的M2-DLS神经回路释放了的谷氨酸水平有所降低。他们随后再次使用光遗传学来反复增强改变后的M2-DLS神经回路,结果表明,这种刺激改善了这种小鼠模型的症状。
2020年12月,Lucas A Hartsough等人开发出一种利用光遗传学直接控制生活在秀丽隐杆线虫肠道中的细菌的基因表达和代谢产物产生的方法。他们对大肠杆菌进行了基因改造,使之在绿光下产生促进寿命的化合物荚膜异多糖酸,并在红光下关闭它的产生。他们发现,将绿光照射在携带经过基因改造后的大肠杆菌的透明线虫上,可以诱导大肠杆菌产生荚膜异多糖酸,从而保护线虫的肠道细胞免受应激引起的线粒体断裂的影响,从而延长这种线虫的寿命。

5.光遗传学在基因组编辑上的潜在应用
2020年6月,Yuanhuan Yu等人成功研发出新型的光控基因编辑系统——分割型split-Cas9(far-red light-activated split-Cas9,简称FAST系统)。他们利用特定LED光源发出的波长730 nm的远红光激活FAST系统。在异种移植肿瘤模型小鼠A549中,他们将FAST系统递送至小鼠体内的肿瘤中,然后在LED远红光的照射下,切割肿瘤致癌基因PLK1。实验结果显示,这能够显著抑制肿瘤生长。

图片来自Science Advances, 2020, doi:10.1126/sciadv.abb1777。
5.小结
当前,在光遗传学技术的使用过程中,科学家们首先要寻找寻合适的光敏蛋白;其次进行相应的遗传信息传递,即通过转染、病毒转导、转基因动物系的建立等方法将光敏蛋白的遗传信息传递给目标细胞;随后科学家们利用可控性演示,通过从时间和空间上控制演示光线的特定性,来实现对细胞活动的精确演示;最后对研究结果进行读取,这一过程研究者可以采用电极通过检测细胞膜内外电压来测量光敏蛋白的荧光效果变化,并可用荧光性生物传感器来检测不同细胞的读出值,进而通过行为测试来评估调整细胞活动对整个动物的影响。
在这个过程中,科学家们应当精确光刺激只会激活或抑制表达了光敏蛋白的神经元,而不能影响其他的神经元。然而,2019年6月,Scott F. Owen等人发现实验中常用的光遗传调控光照强度会引起局部脑组织0.2~2℃的升温,这种光热效应会抑制神经元的放电。这意味着在实际的研究中,应当选择合适的光刺激参数,并且在解释实验结果时应当考虑到光热效应对神经元放电的影响。
除此之外,一些科学家们认为光遗传调控光照强度有可能让神经元放电超出生理范围,这会导致神经回路会出现非生理性的活动模式,从而导致错误的生理学结论。再者,光敏蛋白的表达和光照在神经元群体中并不均匀,从而导致光遗传学操纵的量级和范围会出现异质性。此外,光刺激的位点不同也可能对光遗传学实验的结果产生不同的影响。
目前光遗传学主要是作为一种研究工具,还不能直接用于人类的疾病诊断,但是随着这种技术的不断成熟,它在神经生物学和临床医学等领域的应用将会变得越来越广泛。(生物谷 Bioon.com)
参考资料:
1.Ee-Lynn Yap et al. Bidirectional perisomatic inhibitory plasticity of a Fos neuronal network. Nature, 2020, doi:10.1038/s41586-020-3031-0.
2.Wanling Peng et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science, 2020, doi:10.1126/science.abb0556.
3.Edmund Chong et al. Manipulating synthetic optogenetic odors reveals the coding logic of olfactory perception. Science, 2020, doi:10.1126/science.aba2357.
4.Sara Medero et al. GABAergic signaling to astrocytes in the prefrontal cortex sustains goal-directed behaviors. Nature Neuroscience, 2020, doi:10.1038/s41593-020-00752-x.
5.Xin Gong et al. An ultra-sensitive step-function opsin for minimally invasive optogenetic stimulation in mice and macaques. Neuron, 2020, doi:10.1016/j.neuron.2020.03.032.
6.Andrea Bari et al. Differential attentional control mechanisms by two distinct noradrenergic coeruleo-frontal cortical pathways. PNAS, 2020, doi:10.1073/pnas.2015635117.
7.Hidenori Watanabe et al. Forelimb movements evoked by optogenetic stimulation of the macaque motor cortex. Nature Communications, 2020, doi:10.1038/s41467-020-16883-5.
8.Yanlin He et al. Estrogen receptor-α expressing neurons in the ventrolateral VMH regulate glucose balance. Nature Communications, 2020, doi:10.1038/s41467-020-15982-7.
9. Lucas A Hartsough et al. Optogenetic control of gut bacterial metabolism to promote longevity. eLife, 2020, doi:10.7554/eLife.56849.
10.Sara Fernández-García et al. M2 cortex-dorsolateral striatum stimulation reverses motor symptoms and synaptic deficits in Huntington's disease. eLife, 2020, doi:10.7554/eLife.57017.
11.Rocio Ochoa-Fernandez et al. Optogenetic control of gene expression in plants in the presence of ambient white light. Nature Methods, 2020, doi:10.1038/s41592-020-0868-y.
12.Kazuki Tajima et al. Wireless optogenetics protects against obesity via stimulation of non-canonical fat thermogenesis. Nature Communications, 2020, doi:10.1038/s41467-020-15589-y.
13.Bowen Ji et al. Flexible and stretchable opto-electric neural interface for low-noise electrocorticogram recordings and neuromodulation in vivo. Biosensors and Bioelectronics, 2020, doi:10.1016/j.bios.2020.112009.
14.Yingying Zhang et al. Remote Regulation of Optogenetic Proteins by a Magneto-Luminescence Microdevice. Advanced Functional Materials, 2020, doi:10.1002/adfm.202006357.
15.Minghui Du et al. Flexible Fiber Probe for Efficient Neural Stimulation and Detection. Advanced Science, 2020, doi:10.1002/advs.202001410.
16.Lihui Lu et al. An optical brain-to-brain interface supports rapid information transmission for precise locomotion control. Science China Life Sciences, 2020, doi:10.1007/s11427-020-1675-x.
17.Yuanhuan Yu et al. Engineering a far-red light–activated split-Cas9 system for remote-controlled genome editing of internal organs and tumors. Science Advances, 2020, doi:10.1126/sciadv.abb1777.
18.Scott F. Owen et al. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience, 2019, doi:10.1038/s41593-019-0422-3.
19.邴杰. 光遗传学技术在神经生物学领域的发展及应用. 生物学通报[J]. 2014, 49(11):5-7.
20.Scott F. Owen et al. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience, 2019, doi:10.1038/s41593-019-0422-3.
21.Michael Häusser. Optogenetics: the age of light. Nature Methods, 2014, doi:10.1038/nmeth.3111.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


