溃疡性结肠炎(UC)新药!吉利德/Galapagos口服JAK1抑制剂Jyseleca在英国获批新适应症!
来源:本站原创 2022-01-20 00:38
之前,Jyseleca已被批准治疗类风湿性关节炎(RA)。
溃疡性结肠炎(UC,图片来源:healthjade.com)
2022年01月19日讯 /生物谷BIOON/ --吉利德科学(Gilead Sciences)合作伙伴Galapagos NV近日宣布,英国药品和保健品管理局(MHRA)已批准口服抗炎药Jyseleca(filgotinib,非戈替尼,200mg片剂)一个新的适应症,该药是一种每日口服一次的JAK1优先抑制剂,用于治疗:对常规疗法或生物制剂应答不足、失应答或不耐受的中度至重度活动性溃疡性结肠炎(UC)成人患者。
MHRA的审批决定遵循了欧盟委员会(EC)对Jyseleca治疗同一患者群体的审批决定。在欧盟,Jyseleca于2021年11月获批上述新适应症。Jyseleca将为中重度活动性UC患者群体提供一个新的治疗选择。目前,Jyseleca治疗UC适应症申请也正在接受日本监管机构的审查。
Jyseleca是一种口服选择性JAK1抑制剂,已在欧盟、英国、日本获批上市(Jyseleca 100mg和200mg片剂),用于治疗对一种或多种疾病修饰抗风湿药物(DMARD)应答不足或不耐受的中度至重度类风湿性关节炎(RA)成人患者。用药方面,Jyseleca可作为单药疗法,或与甲氨蝶呤(MTX)联合使用。
值得一提的是,2021年9月,艾伯维向美国FDA和欧盟EMA提交了口服JAK1抑制剂Rinvoq(upadacitinib,乌帕替尼)的新适应症申请:用于治疗中度至重度活动性UC成人患者。Rinvoq也是一种口服选择性JAK1抑制剂。

MHRA批准Jyseleca,基于关键性2b/3期SELECTION项目的数据。该项目评估了Jyseleca作为一种诱导和维持疗法在常规疗法或生物制剂治疗失败的中重度活动性UC成人患者中的疗效和安全性。
SELECTION包括2项安慰剂对照诱导研究,一项针对生物制剂初治(biologic-naive,先前没有接受过生物制剂)患者,另一项针对生物制剂经治(biologic-experienced,先前接受过生物制剂)患者,然后针对治疗10周后对Jyseleca有反应的患者进行一项为期47周的维持研究。安慰剂应答者在维持期继续使用盲法安慰剂。
SELECTION试验结果最近发表与《柳叶刀》,详见:Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): a phase 2b/3 double-blind, randomised, placebo-controlled trial。
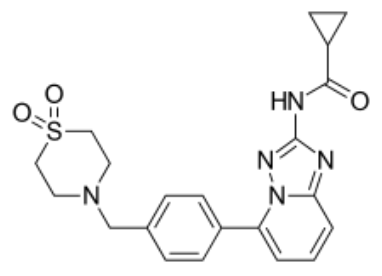
filgotinib分子结构式(图片来源:Wikipedia)
溃疡性结肠炎(UC)是一种慢性炎症性肠病(IBD),特征是结肠和直肠粘膜下层发炎,该病症状往往是间歇性的,因此患者通常会经历发作期和缓解期。除了对身体造成的影响外,该病还会带来显著的心理影响。
Jyseleca的活性药物成分为filgotinib,这是一种高度选择性JAK1抑制剂,由Galapagos发现和开发。吉利德于2015年12月底与Galapagos达成了一项总额高达20亿美元的协议,在全球共同开发和商业化filgotinib。而由于在美国监管方面遭遇的重大挫折,双方在2020年12月修订了filgotinib的商业化及开发协议内容。Galapagos将负责filgotinib在欧洲的商业化(过渡期在2021年底完成),而吉利德将继续负责filgotinib在欧洲以外的地区,包括日本(吉利德在该地区与卫材共同销售filgotinib)。
目前,filgotinib正被开发用于治疗多种炎症性疾病,其中3期研究包括治疗类风湿性关节炎、克罗恩病、溃疡性结肠炎。不过,在JAK抑制剂领域,filgotinib也面临着多个竞争产品,除了2款已上市产品辉瑞Xeljanz和礼来Olumiant之外,更强劲的对手将是艾伯维的Rinvoq(upadacitinib)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


