结直肠癌重磅!辉瑞Braftovi+Erbitux方案美国获批,经治BRAF V600E转移患者的靶向疗法!
来源:本站原创 2020-04-10 15:08
2020年04月10日讯 /生物谷BIOON/ --辉瑞(Pfizer)近日宣布,美国食品和药物管理局(FDA)已批准一份补充新药申请(sNDA):将Braftovi(encorafenib)与Erbitux(cetuximab,西妥昔单抗)联合用药方案(Braftovi二药方案),用于先前治疗后病情进展(经治)、并且经FDA批准的一款检测方法证实携带BRA

2020年04月10日讯 /生物谷BIOON/ --辉瑞(Pfizer)近日宣布,美国食品和药物管理局(FDA)已批准一份补充新药申请(sNDA):将Braftovi(encorafenib)与Erbitux(cetuximab,西妥昔单抗)联合用药方案(Braftovi二药方案),用于先前治疗后病情进展(经治)、并且经FDA批准的一款检测方法证实携带BRAF V600E突变的转移性结直肠癌(mCRC)成人患者的治疗。此前,FDA已授予该申请优先审查和突破性药物资格。
值得一提的是,Braftovi+Erbitux联合用药方案是FDA批准的第一个也是唯一一个专门用于先前接受过治疗且携带BRAF V600E突变的mCRC成人患者的靶向方案。
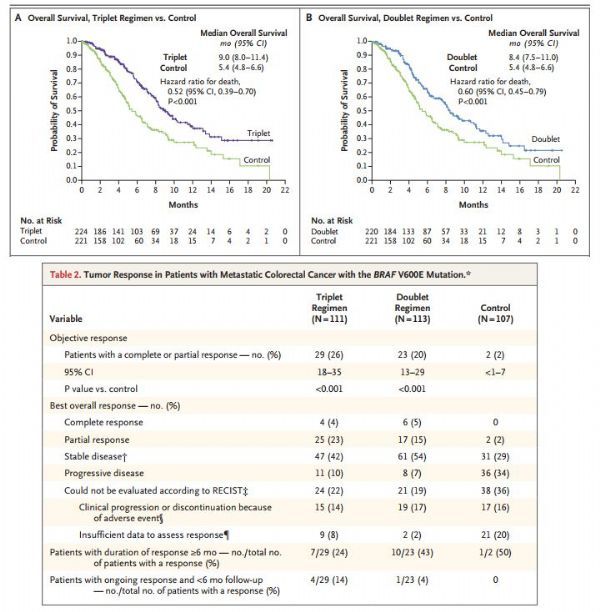
此次批准基于III期BEACON CRC试验的结果。这是唯一一项专门研究先前接受过治疗且携带BRAF V600E突变的mCRC患者的III期试验。该试验在先前接受过一种或两种疗法治疗后病情进展的BRAF V600E突变mCRC患者中开展,评估了Braftovi二药方案(Braftovi+Erbitux)、Braftovi三药方案(Braftovi+Erbitux+Mektovi)、Erbitux与含伊立替康的治疗方案联合用药(对照方案:伊立替康+Erbitux,或FOLFIR+Erbitux)的疗效和安全性。
结果显示,与对照组相比,Braftovi二药方案治疗组和三药方案治疗组总生存期(OS)和客观缓解率(ORR)均表现出改善。描述性分析结果显示,在总的研究群体中,二药方案和三药方案的疗效相当。二药方案和三药方案没有表现出非预期的毒性。
具体数据为:(1)Braftovi二药方案组的中位OS为8.4个月(95%CI:7.5,11.0),对照组为5.4个月(95%CI:4.8,6.6),数据具有统计学显著差异(HR=0.60;95%CI:0.45,0.79;p=0.0003)。(2)Braftovi二药方案组ORR为20%(95%CI:13%,29%),对照组为2%(95%CI:0%,7%),数据也具有统计学显著差异(p<0.0001)。(3)Braftovi二药方案组中位无进展生存期(mPFS)为4.2个月(95%CI:3.7,5.4),对照组为1.5个月(95%CI:1.4,1.7),数据具有统计学显著差异(HR=0.40;95%CI:0.31,0.52;p<0.0001)。(4)Braftovi二药方案组,最常见的不良反应(AR)为疲劳、恶心、腹泻、痤疮性皮炎、腹痛、食欲减退、关节痛和皮疹。
辉瑞全球产品开发肿瘤学首席开发官、医学博士Chris Boshoff表示:“我们致力于开发靶向药物,帮助患者治疗由特定突变引起的癌症。此次FDA批准Braftovi与Erbitux联合二药方案,我们感到非常高兴。我们感谢参与III期BEACON CRC试验的患者和研究调查人员,并为现在能够为先前接受过治疗的BRAF V600E突变mCRC患者带来第一种靶向治疗方案而感到自豪。展望未来,我们将致力于继续探索这种靶向二药方案用于早期治疗,包括正在进行的II期ANCHOR研究中治疗先前未接受治疗的BRAF突变mCRC患者。”
德克萨斯大学MD安德森癌症中心胃肠内科肿瘤学副教授Scott Kopetz表示:“据估计,BRAF突变发生在高达15%的mCRC患者中,对这些患者来说是一种不良的预后因素。作为BRAF V600E突变mCRC患者的第一个也是唯一一个靶向治疗方案,Braftovi与Erbitux联合用药方案是这些患者急需的一个新治疗方案。”
2019年11月2日,欧洲药品管理局(EMA)也启动了审查程序,对法国制药公司皮尔法伯集团(Pierre Fabre)提交的Braftovi二药方案治疗BRAF V600E突变mCRC患者的II类变更申请进行审查。
在全球范围内,结直肠癌(CRC)是男性第三大常见癌症,是女性第二大常见癌症,2018年新诊断约180万例。仅在美国,预计2020年将有147950人被诊断为结肠癌或直肠癌,每年约53000人死于这种疾病。据估计,BRAF突变出现在高达15%的转移性结直肠癌(mCRC)患者中,这些患者的预后很差。BRAF V600E突变是最常见的BRAF突变,携带BRAF V600E突变的CRC患者死亡率是野生型BRAF患者的2倍以上。

Braftovi的活性药物成分encorafenib是一种口服小分子BRAF抑制剂,Mektovi的活性药物成分binimetinib则是一种口服小分子MEK抑制剂。MEK和BRAF是MAPK信号通路(RAS-RAF-MEK-ERK)中的2种关键蛋白激酶。研究表明,这一通路调节了包括细胞增殖、分化、存活、血管生成在内的多种关键细胞活动。在许多癌症中,如黑色素瘤、结直肠癌和甲状腺癌,这一信号通路中的蛋白质已被证实异常激活。
在美国,Braftovi+Mektovi组合已被批准用于BRAF V600E或BRAF V600K突变的不可切除性或转移性黑色素瘤。Braftovi不适合治疗野生型BRAF黑色素瘤。在欧洲,该组合被批准用于BRAF V600突变的不可切除性或转移性黑色素瘤成人患者。在日本,该组合被批准用于BRAF突变的不可切除性黑色素瘤。
Braftovi和Mektovi由Array BioPharma发现和开发。2019年6月,辉瑞以114亿美元将Array BioPharma收购。目前,辉瑞拥有2款药物在美国和加拿大的独家权利。小野制药授权获得2款药物在日本的韩国的独家权利,Medison授权获得2款药物在以色列的独家权利,皮尔法伯集团授权获得2款药物在所有其他国家的独家权利,包括欧洲、拉美和亚洲(日本和韩国除外)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->