CAR-T细胞疗法研究进展(第34期)
来源:生物谷原创 2023-01-31 05:34
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science子刊:新研究表明CAR-T细胞疗法有望清除实体瘤手术后残留的肿瘤细胞
doi:10.1126/sciadv.ade2526
在一项新的临床前研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现作为一种重编程患者自身免疫细胞以攻击其血癌的方法,CAR-T细胞疗法可能会提高外科手术治疗实体瘤的有效性。相关研究结果发表在2023年1月13日的Science Advances期刊上,论文标题为“Chimeric antigen receptor T cells as adjuvant therapy for unresectable adenocarcinoma”。

降低局部治疗小鼠的靶外毒性。图片来自Science Advances, 2023, doi:10.1126/sciadv.ade2526。
在这项新的研究中,他们设计的CAR-T细胞靶向一种称为间皮素(mesothelin)的蛋白,其中间皮素是这两种类型肿瘤细胞的表面标记。如果不给送他们设计的含有CAR-T细胞的纤维蛋白凝胶,剩余的肿瘤组织就会增长,小鼠在大约七周内就会死亡。然而,在给送这种含有CAR-T细胞的纤维蛋白凝胶后,20只小鼠中的19只体内残留的肿瘤组织迅速消失,而且这些19只小鼠在观察期的剩余时间里没有伤口愈合并发症或其他明显的副作用。
进一步的实验表明,靶向间皮素的CAR-T细胞有可能在静脉注射后攻击携带这种蛋白标志物的健康细胞,而且与直接将这些CAR-T细胞注入血液相比,局部注射这些CAR-T细胞的毒性降低了。
2.JITC:利用STAb-T细胞疗法有望治疗T细胞急性淋巴细胞白血病
doi:10.1136/jitc-2022-005333
在一项新的研究中,西班牙研究人员开发了一种细胞疗法,用于治疗一种目前几乎没有治疗选择的白血病类型。这种STAb-T细胞疗法以STAb-T细胞为基础,可能能够用于治疗化疗或骨髓移植无效的T细胞急性淋巴细胞白血病(T-ALL)患者。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Efficient preclinical treatment of cortical T cell acute lymphoblastic leukemia with T lymphocytes secreting anti-CD1a T cell engagers”。
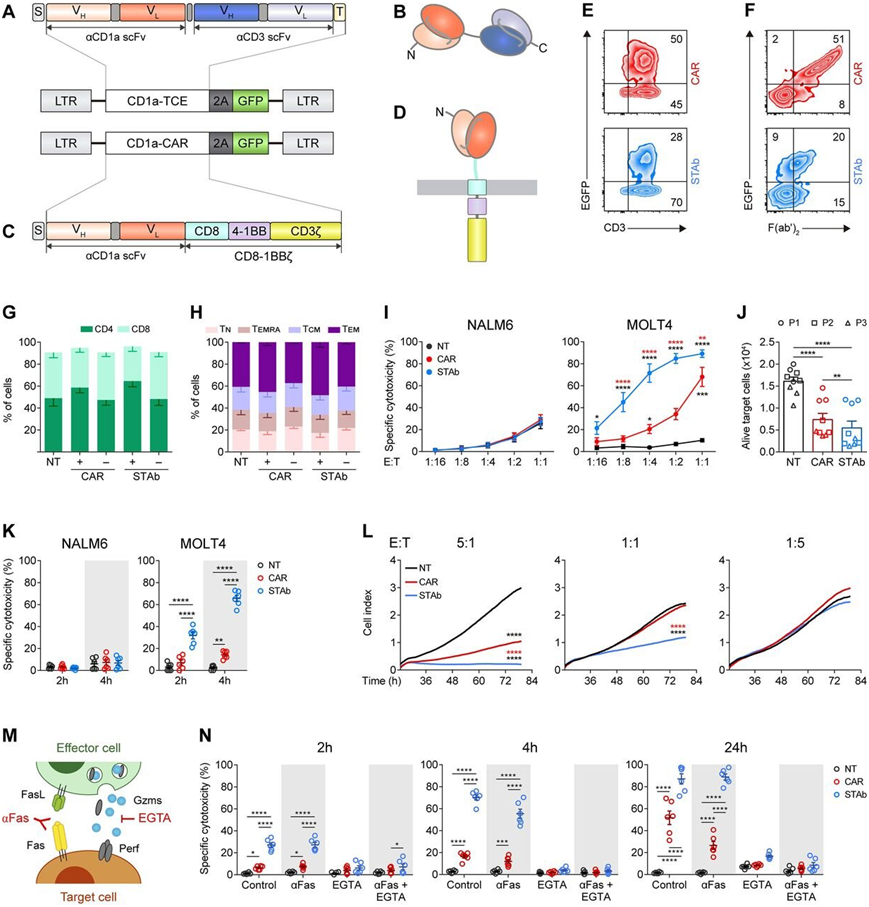
CD1a-STAb T细胞和CD1a-CAR-T细胞的体外比较研究。图片来自Journal for ImmunoTherapy of Cancer, 2022, doi:10.1136/jitc-2022-005333。
STAb-T细胞疗法是目前正在彻底改变癌症治疗的CAR-T细胞疗法的演变。CAR-T细胞疗法是基于对患者自身的免疫细胞--- T细胞---的基因改造,使之能够表达识别和消除肿瘤细胞的人工嵌合受体(artificial chimeric receptor, CAR)。
与CAR-T细胞疗法---这种细胞疗法中的 T细胞表达一种带有单特异性抗体的受体,该单特异性抗体能够识别肿瘤表面上的一种靶标---相比,STAb-T细胞疗法的优势在于,它基于分泌一种特殊类型的双特异性抗体,能够识别两种靶标:一种位于在肿瘤细胞上,另一种位于T细胞上。通过这种方式,该双特异性抗体形成了一种人工桥梁,使得治疗性T细胞与肿瘤细胞接触,促进了肿瘤细胞消除并让健康的T细胞保持安全。
doi: 10.1073/pnas.2213222120
在一项新的研究中,来自美国哈佛大学怀斯生物启发工程研究所、哈佛大学工程与应用科学院(SEAS)和丹娜法伯癌症研究院的研究人员利用一种非自然的糖,该糖被吸收并整合到T细胞的外部涂层中,然后可以用来锚定细胞因子。相关研究结果近期发表在PNAS期刊上,论文标题为“Cytokine conjugation to enhance T cell therapy”。
这些被锚定的细胞因子在局部增强了T细胞的功能,而不产生不必要的全身性副作用。在患有黑色素瘤(一种侵袭性实体肿瘤)的小鼠中,该方法还刺激了宿主的免疫系统对抗肿瘤细胞,从而抑制了肿瘤的生长。作为CAR-T细胞疗法的补充,它允许在其他非治愈性细胞剂量下完全消退淋巴瘤肿瘤。
论文通讯作者、哈佛大学工程与应用科学院生物工程教授David Mooney博士说,“我们看到的结果表明,朝着开发对实体瘤有疗效的ACT和对多种血癌有更稳定疗效的ACT迈出了一大步。我们的方法可以很容易地扩大规模,并与目前用于制造治疗性T细胞(包括CAR-T细胞)的工艺相结合,因此可能有一个相对较短的路径进入临床应用。”
4.Science:合成IL-2回路促进CAR-T细胞浸润免疫抑制性的实体瘤
doi:10.1126/science.aba1624
许多实体瘤对T细胞疗法没有反应,因为它们的免疫抑制性微环境阻止了T细胞的浸润、激活和增殖。主要的肿瘤抑制机制包括抑制T细胞受体(TCR)的信号传导和消耗炎性细胞因子。克服抑制性肿瘤微环境仍然是实体瘤免疫疗法的一个主要障碍。
用炎性细胞因子---比如高剂量的IL-2---补充T细胞的活性,长期以来一直被认为可以驱动有效的抗肿瘤功能。然而,全身性IL-2治疗已被证明具有很强的毒性,会导致严重的不良反应,包括毛细血管渗漏综合征和最终的终末器官功能障碍。细胞自主的细胞因子产生有潜力通过在局部和直接向肿瘤递送细胞因子来克服这些毒性。在一项新的研究中,来自美国加州大学旧金山分校的研究人员设计出携带合成细胞因子回路的治疗性T细胞,在其中,肿瘤特异性synNotch(synthetic Notch)受体驱动IL-2的产生。这种靶向肿瘤的IL-2递送回路提供了一种潜在的方法,可以在局部克服肿瘤抑制,同时将全身性IL-2治疗的毒性降到最低。相关研究结果发表在2022年12月16日的Science期刊上,论文标题为“Synthetic cytokine circuits that drive T cells into immune-excluded tumors”。
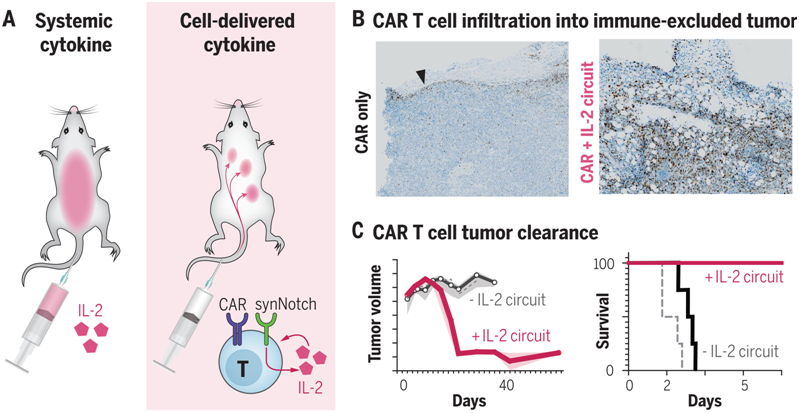
经过基因改造后的治疗性T细胞在肿瘤触发IL-2产生后浸润并清除免疫抑制性的肿瘤。图片来自Science, 2022, doi:10.1126/science.aba1624。
这些作者察到他们设计的synNotch诱导IL-2产生的回路(下称synNotch→IL-2回路)促使嵌合抗原受体(CAR)或TCR T细胞有效地浸润到胰腺癌和黑色素瘤的免疫抑制性肿瘤模型中。在这些具有挑战性的免疫功能的肿瘤模型中,这种浸润的改善与肿瘤清除率和生存率的大幅提高有关。与全身递送IL-2不同,这种局部的IL-2回路不显示毒性,因为它不依赖于TCR/CAR的激活,但仍靶向肿瘤。
然而,用于递送IL-2的确切机制被证明是至关重要的。与经设计后IL-2组成性表达或TCR/CAR诱导的IL-2表达(如来自活化T细胞核因子(NFAT)启动子)的CAR-T细胞相比,携带synNotch→IL-2回路的CAR-T细胞具有更好的抗肿瘤效果。此外,这些作者发现,IL-2的自分泌产生,即同一T细胞表达CAR/TCR和synNotch→IL-2回路,被证明是至关重要的。IL-2的旁分泌递送,即CAR-T细胞受到携带synNotch→IL-2回路的独立T细胞支持,在存在竞争性的内源性IL-2消耗细胞(即消耗IL-2的细胞)---比如宿主调节性T细胞或旁观者T细胞---时,被证明是无效的。
高维免疫分析显示这种IL-2合成细胞因子回路主要作用于T细胞群体,而不会对其他免疫细胞区室造成明显变化。CAR-T细胞和宿主旁观者T细胞对肿瘤的浸润都明显增加。然而,只有抗肿瘤的CAR-T细胞显示出增加的激活、增殖和细胞毒性标志物,以及下降的衰竭标志物。
这些作者猜测这种synNotch→IL-2回路是有效的,因为它绕过了对TCR/CAR激活的要求,并以更强有力的自分泌方式提供IL-2。因此,这些特征使得工程化T细胞能够克服肿瘤免疫抑制的主要模式:抑制TCR信号传递和竞争性细胞因子消耗。这些工程化T细胞似乎充当了先锋,通过它们的由synNotch诱导的IL-2产生在肿瘤中引发增殖,然后协同性地启动CAR/TCR介导的持续性T细胞激活和杀伤。
5.Science:利用组合信号基序库和机器学习破解CAR-T细胞表型
doi:10.1126/science.abq0225
在一项新的研究中,来自美国加州大学旧金山分校和IBM阿尔马登研究中心的研究人员利用新的机器学习技术,基于指导工程化免疫细胞寻找并不知疲倦地杀死癌细胞的“单词”组合,为细胞开发了一个包含数千条“命令语句”的虚拟分子库。相关研究结果发表在2022年12月16日的Science期刊上,论文标题为“Decoding CAR T cell phenotype using combinatorial signaling motif libraries and machine learning”。

具有新型信号基序组合的CAR在汇集筛选中产生不同的T细胞增殖、记忆形成和脱颗粒输出。图片来自Science, 2022, doi:10.1126/science.abq0225。
这项新研究代表着如此复杂的计算方法首次应用于一个领域,到目前为止,这个领域主要是通过临时修补和利用现有分子而不是合成分子改造细胞来取得进展。
这一新的进展使科学家们能够预测他们应该在细胞中包括哪些自然的或合成的元素以使其具有有效应对复杂疾病所需的精确行为。
论文共同通讯作者、加州大学旧金山分校细胞设计研究所负责人Wendell Lim博士说,“这是该领域的一个重要转变。只有拥有这种预测的能力,我们才能快速设计出新的执行所需活动的细胞疗法。”
6.Front Immunol:科学家发现用于早期预测癌症患者对CAR-T细胞疗法反应的新型生物标志物
doi:10.3389/fimmu.2022.1004703
靶向作用B细胞特异性分化抗原CD19的前和抗原受体T(CART)在一部分复发性/难治性弥漫大B细胞淋巴瘤(DLBCL)中表现出了一定的临床疗效;尽管存在一定的异质性反应,但目前对预测CAR-T细胞疗法反应性的血液预灌注生物标志物的研究还不够充分;近日,一篇发表在国际杂志Frontiers in Immunology上题为“The frequency of differentiated CD3+CD27-CD28- T cells predicts response to CART cell therapy in diffuse large B-cell lymphoma”的研究报告中,来自维也纳医科大学等机构的科学家们通过研究发现了一种针对CAR-T细胞疗法临床反应的高度潜在的生物标志物,同时还描述了最佳使用这种新型疗法用来治疗淋巴瘤的先决条件,目前的研究发现是优化这种潜在疗法的重要一步。
弥漫性大B细胞淋巴瘤(DLBCL,Diffuse large B cell lymphoma)是一种最常见的淋巴瘤(非霍奇金淋巴瘤),相应患者的5年生存率在55%-64%之间,然而,疾病发生早期复发或对联合抗体化疗并没有反应的患者的预后或许更差。近年来,对于受影响的患者而言出现了一种非常有效的疗法形式,即CAR-T细胞,在这种疗法中,机体自身的淋巴细胞会被抽取出来,并配备能特异性针对淋巴癌细胞的嵌合T细胞受体(CAR),随后细胞会进行增殖并重新输注回患者体内,由于嵌合T细胞受体的表达,T细胞就会转变为杀手细胞,而且在最好的情况下,其还能永远消除患者体内的淋巴癌细胞。尽管当CAR-T细胞对淋巴瘤细胞存在反应时这种疗法可以非常有效,且能实现长期生存,但不幸的是,其并不会对所有患者都有效。
在这项临床研究中,科学家们从CAR-T细胞产生的原点开始,即患者自身T淋巴细胞的特质;在这一过程中,他们发现,淋巴瘤患者通常会存在T淋巴细胞的缺失(T细胞淋巴细胞减少症),由于淋巴细胞的减少通常会伴随耗竭T细胞的增加,于是研究人员就开始测定这些细胞的数量;的确,研究人员在一部分患者中发现其机体耗竭T细胞的数量会明显增加,诸如此类耗竭T细胞通常只有在遭受慢性炎症的患者中存在。
基于这些观察,研究人员将患者群体分为对CAR-T细胞疗法反应概率高和反应概率低的群体。研究者Winfried Pickl说道,本文研究结果表明,T细胞的性质对于CAR-T细胞的产生是非常重要的,而且在相当大的一部分比例患者机体也会发现耗竭的T细胞,这对于后续CAR-T细胞疗法的进行或许构成了问题。研究人员对被用作CAR-T细胞产生的起始材料的不同耗竭T细胞的作用方式进行观察后发现,分化程度并不会对CAR-T直接杀死癌细胞产生负面影响,但其对于白血病细胞依赖性生长和CAR-T细胞的因子产生或许存在一定的负面影响;相关研究结果表明,耗竭的CD27-CD28-CAR-T细胞或许无法在患者体内持续较长时间,这或许就会限制其长期疗效。
7.Nat Med:新型的T细胞疗法或能表现出早期的抗肿瘤活性
doi:10.1038/s41591-022-02128-z
亲和力优化的T细胞受体能增强过继T细胞疗法的效力,近日,一篇发表在国际杂志Nature Medicine上题为“Autologous T cell therapy for MAGE-A4+ solid cancers in HLA-A*02+ patients: a phase 1 trial”的研究报告中,来自德克萨斯大学MD安德森癌症中心等机构的科学家们通过研究表示,在I期临床试验中,一种名为Afamitresgene autoleucel (afami-cel; 此前称之为ADP-A2M4)的靶向作用MAGE-A4癌症抗原的过继T细胞受体疗法(TCR)在多种实体瘤患者中取得了明显的治疗结局。
研究者表示,这类疗法的疗效在滑膜瘤亚群患者中尤其值得注意,该疗法在这类癌症患者中取得了44%的客观反应率,而在所有类型癌症中的总体反应率为24%;这项临床试验的初期数据已经在2020年美国临床肿瘤学会(ASCO)年会上进行了公布,早期研究结果阐明了新型细胞疗法在实体瘤中的概念验证结果。研究者Hong说道,患者机体所出现的较高的反应率是非常重要的,因为滑膜瘤患者在使用高剂量的异环磷酰胺(Ifosfamide)化疗后真正的治疗选择非常有限,afami-cel疗法的总体毒性是可控的,而且研究者在其它类型癌症中也观察到了其早期活性的相关证据;相关研究结果表明,这或许是一种可能在实体瘤中发挥作用的方法,目前在治疗这些实体瘤中还没有被批准的细胞疗法。
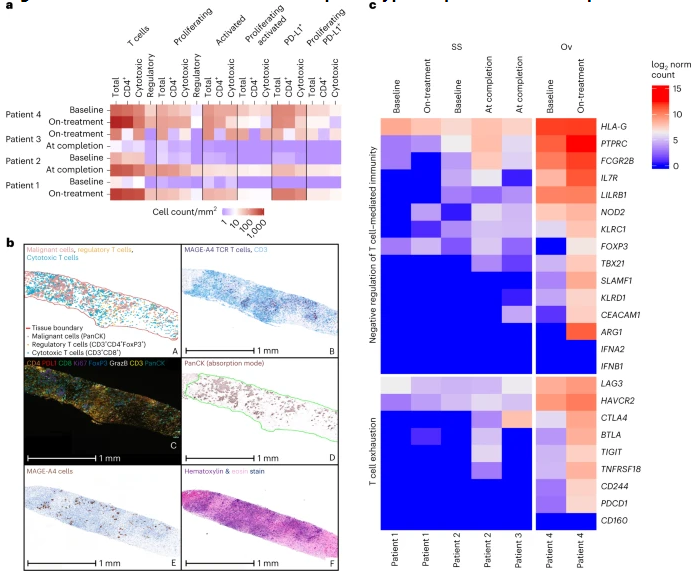
新型的T细胞疗法或能表现出早期的抗肿瘤活性。图片来源:Nature Medicine (2023). DOI:10.1038/s41591-022-02128-z.
TCR疗法的目的在于更加准确地靶向作用实体瘤细胞,且并不会对通常与基于嵌合抗原受体(CAR)的细胞疗法相关的正常细胞产生毒性作用;与基于CAR的细胞疗法(其能识别指定的细胞表面蛋白)不同的是,诸如afami-cel等TCR疗法能靶向作用细胞内存在的特殊蛋白,而利用T细胞原始受体,TCR疗法就能识别特殊的蛋白质片段(比如来自MAGE-A4)与细胞表面的免疫相关蛋白进行结合。这项研究中共有38名患者利用afami-cel疗法进行了治疗,这些患者此前平均有三条治疗线,参与者中58%为男性,92%的参与者为白人,其余则是亚洲人;该研究纳入了16名滑膜瘤患者、9名卵巢癌患者、3名头颈癌患者、同时食道癌患者、非细胞细胞肺癌患者、尿道癌以及粘液样/圆形细胞脂肪肉瘤患者各2名,以及胃癌和黑色素瘤患者各1名。
所有患者均经历了与疗法相关的不良事件,其中以低血细胞计数(淋巴细胞减少症、白细胞减少症、中性粒细胞减少症、贫血和血小板减少症)最为常见。17名患者(45%)在afami-cel疗法后4周出现了长期的细胞减少症,其中2名患者出现了与试验相关的死亡,这就会降低其在筛选时的最大年龄,并停止使用大剂量的环磷酰胺淋巴细胞剔除策略。所有患者的中位反应时间为26周,滑膜瘤患者亚群为28周。在滑膜瘤患者中所得到的研究结果就会促进科学家们针对晚期滑膜瘤或粘液样/圆形细胞脂肪肉瘤患者的II期afami-cel试验。
8.Cell:除了治疗血癌外,CAR-T细胞也有望治疗自身免疫性疾病
doi:10.1016/j.cell.2022.10.026
称为CAR-T细胞的工程化免疫细胞(即经过基因改造后表达CAR的免疫细胞)已经向世界展示了个性化的免疫疗法在对抗血癌方面的作用。如今,科学家们已报告了CAR-T细胞疗法在一小部分患有称为狼疮的自身免疫性疾病的患者身上取得的非常有希望的早期结果。美国宾夕法尼亚大学佩雷尔曼医学院CAR-T细胞疗法先锋Carl June博士和宾夕法尼亚大学佩雷尔曼医学院细胞与分子生物学博士生Daniel Baker在2022年11月23日的Cell期刊上发表了一篇标题为“CAR T therapy extends its reach to autoimmune diseases”的综述文章,讨论了这一进展。
CAR-T细胞疗法是利用每名患者自己的免疫细胞构建出来的---从患者的血液中收集T细胞,然后在实验室中对它们进行基因改造使之识别特定的靶细胞,并在实验室中增殖,然后作为 “活药物”重新输注到患者体内。第二种CAR-T细胞疗法,Kymriah,是由June和他在宾夕法尼亚大学佩雷尔曼医学院的团队开发的,并在2017年获得了美国食品药品管理局(FDA)批准。如今美国有六种获得FDA批准的CAR-T细胞疗法,用于治疗六种不同的癌症。这些疗法已经彻底改变了某些B细胞白血病、淋巴瘤和其他血癌的治疗方法,使许多原本希望渺茫的患者得到长期缓解。
从CAR-T细胞研究的一开始,专家们就相信T细胞可以经过基因改造后对抗B细胞癌以外的许多疾病。世界各地的几十个研究团队,包括宾夕法尼亚大学佩雷尔曼医学院和生物技术公司的团队,正努力从宾夕法尼亚大学开发的个性化细胞治疗构建中开发出有效的治疗方法,并在研究这些潜在的新应用。
9.Science:靶向中介体复合物激酶模块可增强CAR-T细胞的抗肿瘤效力
doi:10.1126/science.abn5647
T细胞免疫疗法对某些癌症显示出令人印象深刻的疗效,但大多数患者并没有获得持久的反应。这类免疫疗法取得进展的核心障碍是T细胞效力不足,无法根除巨大的肿瘤负担,这是由多种因素造成的,包括T细胞衰竭、衰老、无能(anergy)和免疫抑制。基因编辑有潜力提高癌症免疫疗法的疗效,但目前仍不清楚哪些基因或哪组基因在编辑后能最有效地提高T细胞的效力。
在一项新的研究中,来自美国斯坦福大学的研究人员在人类T细胞中使用全基因组的CRISPR基因敲除筛选,以确定T细胞活力的调节因子。相关研究结果发表在2022年11月11日的Science期刊上,论文标题为“Enhanced T cell effector activity by targeting the Mediator kinase module”。
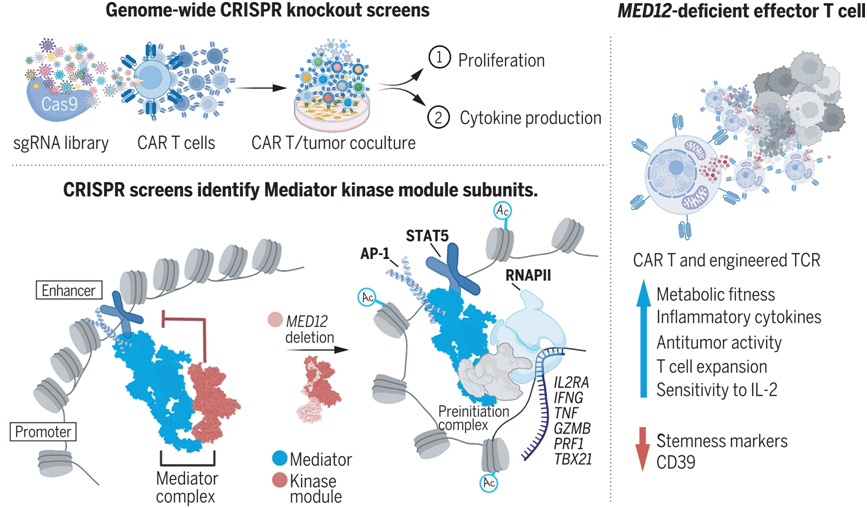
在人类T细胞中,破坏中介体复合物激酶模块会在转录上重新连接效应编程。图片来自Science, 2022, doi:10.1126/science.abn5647。
这些作者在人类嵌合抗原受体(CAR)T细胞(CAR-T)中进行了两次CRISPR筛选,使用的模型系统通过模拟慢性抗原暴露来诱导T细胞功能障碍。基于较高的增殖率和细胞因子产生率是最有效的抗肿瘤T细胞的特征这一假设,他们确定了在肿瘤暴露后增殖并产生白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNFα)的T细胞中富含的向导RNA(gRNA)。
两次CRISPR筛选都发现了编码中介体复合物(Mediator complex)亚基的基因,这些基因包含在中介体复合物激酶模块中。中介体复合物作为增强子结合的转录因子和通用转录复合物(transcription machinery)之间的桥梁,通过协调转录网络在建立细胞身份方面起着核心作用。在人类CAR-T细胞中靶向剔除MED12(中介体复合物亚基12)或CCNC(细胞周期蛋白C)可导致增殖、细胞因子产生和肿瘤清除率增加。对于靶向多种肿瘤抗原和使用CD28或4-1BB共刺激的CAR以及在表达工程化T细胞受体(TCR)的T细胞中也观察到类似的效果。在许多模型系统中,具有干性(stemness)表型和转录组特征的T细胞显示出更高的抗肿瘤效力,然而,MED12缺失的T细胞显示出干性减弱和增强的效应细胞表型和转录组特征。与效应细胞的表型一致,MED12缺失的T细胞显示出增强的代谢活性和效力,其特点是糖酵解、氧化磷酸化和备用呼吸能力增加。MED12缺失的T细胞在长期培养和在体外和体内反复暴露于肿瘤后表现出持续的效力。小分子介导的对细胞周期蛋白依赖性激酶8和19(CDK8/19)---中介体复合物激酶模块的催化亚基---的抑制同样增加了健康的非工程化T细胞的增殖。
为了为理解这些观察结果提供基础,这些作者评估了MED12缺失的T细胞中染色质可及性和修饰的变化。通过使用染色质免疫沉淀测序,他们证实中介体复合物激酶模块和中介体复合物核心模块(core Mediator)在野生型CAR-T细胞中基本是共定位的,但MED12的缺失增加了中介体复合物核心模块在800多个基因组区域的染色质占用。这与已知的中介体复合物激酶模块在调节中介体复合物核心模块和RNA聚合酶II(RNAPII)之间的相互作用是一致的,并导致了这样的假设:T细胞中MED12或CCNC的缺失会选择性地减少中介体复合物核心模块和RNAPII之间的立体阻碍,从而增加转录和调节T细胞功能。与此相一致的是,在MED12缺失的CAR-T细胞中,MED1染色质占有率增加的区域表现为H3K27乙酰化增加,并且富集了在T细胞命运中起关键作用的转录因子---包括几个STAT和AP-1家族成员---所使用的增强子。在MED12缺陷的T细胞中,观察到最明显的增强是STAT5,它表现为对IL-2的敏感性增加。非工程化T细胞对IL-2的敏感性增加也可能是由于接触小分子CDK8/19抑制剂。
10.Clin Transl Immunol:利用癌症免疫治疗技术开发出有潜力治疗SARS-CoV-2感染的免疫疗法
doi:10.1002/cti2.1421
数百万人因感染SARS-CoV-2而死亡,还有数百万人继续经历着新冠长期后遗症(Long COVID),这使得发现实用的、可获得的、强大的SARS-CoV-2预防措施和COVID-19治疗方法至关重要。
在一项新的研究中,美国杰克逊基因组医学实验室的Derya Unutmaz博士和他的研究团队将通常用于癌症治疗的CAR-T细胞疗法用于消除SARS-CoV-2病毒。他们展示了几种基于免疫的策略,以探索COVID-19的治疗和预防。相关研究结果近期发表在Clinical & Translational Immunology期刊上,论文标题为“Targeting SARS-CoV-2 infection through CAR-T-like bispecific T cell engagers incorporating ACE2”。
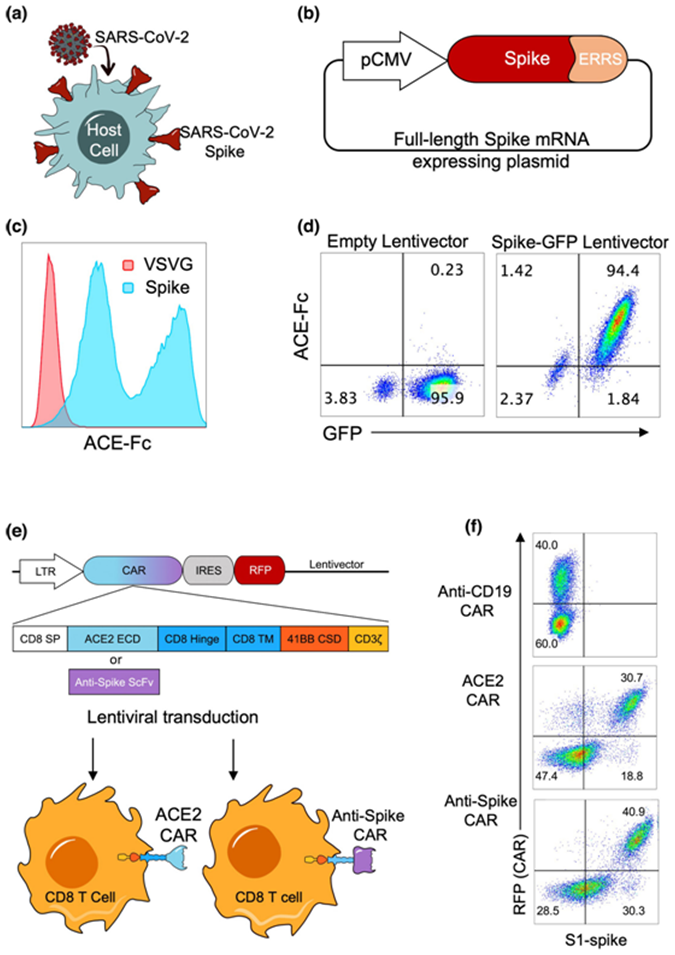
对人类原代CD8 T细胞进行基因改造使之表达靶向呈现SARS-CoV-2刺突蛋白的宿主细胞的CAR分子。图片来自Clinical & Translational Immunology, 2022, doi:10.1002/cti2.1421。
第一种免疫疗法着重关注SARS-CoV-2病毒表面上存在的刺突蛋白和宿主细胞表面上的受体--血管紧张素转换酶2(ACE2)。这种刺突蛋白负责感染健康的宿主细胞。该蛋白通过ACE2受体进入宿主细胞,使这种病毒的RNA开始接管它。在这项新的研究中,T细胞经过基因改造后成为抗刺突蛋白和抗ACE2的CAR-T细胞,靶向刺突蛋白或ACE2受体,在多种受感染的细胞类型中具有高特异性和效率。
第二种免疫疗法提供了一种基于抗体的预防SARS-CoV-2感染的手段。T细胞经基因改造后表达一种与ACE2融合在一起的双特异性抗体,以激活患者自身的T细胞,摧毁在受到感染后在细胞表面上呈现SARS-CoV-2刺突蛋白的宿主细胞。这种ACE2-双特异性抗体疗法不是让身体外的细胞经过基因改造后来杀死受感染的细胞,而是激活个体内的健康T细胞来靶向感染后呈现SARS-CoV-2刺突蛋白的宿主细胞。
这种针对COVID-19的CAR-T细胞疗法和这种基于ACE2-双特异性抗体的疗法都为未来COVID-19的治疗和预防提供了有前景的潜在策略。
11.Blood:在不同社会经济水平的ALL儿童患者中,CAR-T细胞治疗结果相似
doi:10.1182/blood.2022017866
健康的社会决定因素影响着许多疾病的结果,儿童癌症也不例外。事实上,生活在贫困中的急性淋巴细胞白血病(ALL)患儿比来自富裕家庭的患儿更容易出现癌症复发和死亡。在一项新的研究中,来自美国宾夕法尼亚大学和费城儿童医院等研究机构的研究人员指出虽然社会经济地位经常影响生存结果,但生活在贫困中的复发/难治性ALL儿童在接受CAR-T细胞治疗后,与来自社会经济条件较好的家庭的儿童一样有可能获得总体生存。相关研究结果于2022年11月9日在线发表在Blood期刊上,论文标题为“Impact of poverty and neighborhood opportunity on outcomes for children treated with CD19-directed CAR T-cell therapy”。
他们的结果显示,生活于贫困家庭、社区机会较少的患者与来自更有优势的家庭(未生活于贫困家庭或社区机会较高)的患者在总生存率或完全缓解率方面没有显著差异。
有趣的是,这些数据还表明,来自更有优势的家庭的儿童在转诊接受CAR-T细胞输注时,明显更可能出现高疾病负担。鉴于高疾病负担与较差的结果和更大的毒性风险有关,那些出现严重疾病形式的儿童通常被认为在CAR-T细胞治疗中面临更大的风险。
论文通讯作者、费城儿童医院肿瘤学者Allison Barz Leahy博士解释说,“虽然我们知道疾病负担较重的患者一般病情较重,但是这些数据表明,那些来自更有利的家庭、疾病负担较重的患者仍然在转诊接受CAR-T细胞治疗,而那些来自较低社会经济群体的患者可能没有被转诊或者在倡导同样的治疗时可能面临更多挑战。我们不能确切地说,为什么我们看到了疾病负担的差异,但它可能是由于医生转诊偏见,来自更有优势的家庭有更多的资源来获得CAR-T细胞,有更大的灵活性来请假接受治疗,或者在家庭如何倡导他们的孩子接受这种治疗方面可能存在差异。”
12.JITC:通过电穿孔递送mRNA开发出靶向GPC2的CAR-T细胞,有望用于治疗儿童脑瘤
doi:10.1136/jitc-2021-004450
尽管免疫疗法已经彻底改变了许多血癌的治疗,但是这个领域在开发类似的实体瘤治疗方法时遇到了挑战。儿童脑瘤是儿童癌症死亡的主要原因。当开发针对到儿童脑瘤的免疫疗法时,所面临的挑战包括在肿瘤表面确定良好的靶标,以及如何让这种方法在大脑发挥作用时不引起不必要副作用。
如今,在一项新的概念验证研究中,来自美国费城儿童医院的研究人员确定了一种存在于多种儿童脑瘤表面上的蛋白,并找到了一种在临床前模型中利用免疫疗法安全和有效地靶向这种蛋白的方法。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors”。
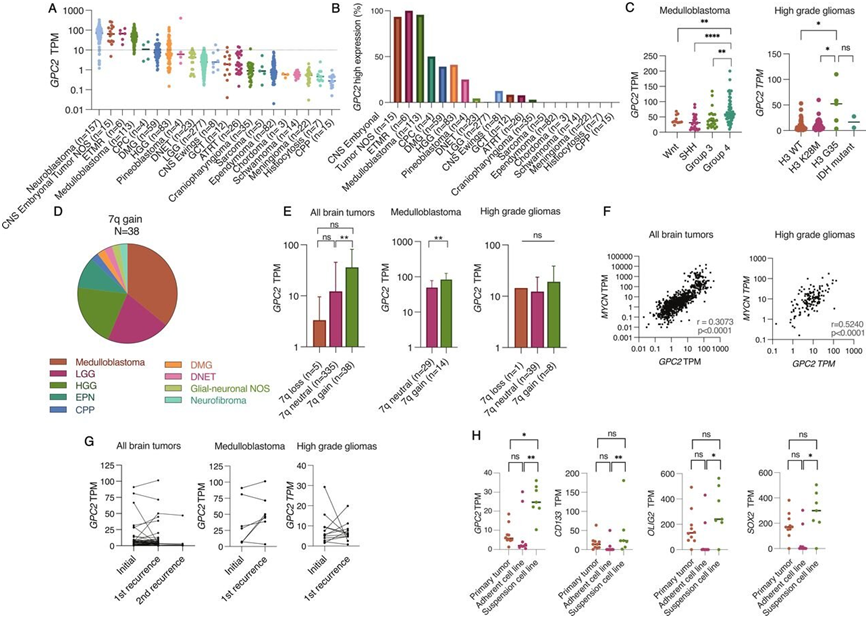
GPC2在儿童脑瘤中表达。图片来自Journal for ImmunoTherapy of Cancer, 2022, doi:10.1136/jitc-2021-004450。
这些作者首先调查了蛋白glypican 2 (GPC2)是否在脑瘤细胞表面上表达,因为费城儿童医院和其他研究机构先前的研究已表明这种蛋白在神经母细胞瘤(neuroblastoma)、其他儿童脑瘤和成年人脑瘤表面上过度表达。GPC2具有称为一种良好的免疫疗法靶标的许多关键特质,费城儿童医院和其他研究机构利用靶向GPC2的免疫疗法治疗神经母细胞瘤的临床前研究工作已导致一项临床试验,将于2023年初开始招募。
为了更好地控制靶向GPC2的CAR在大脑中的水平,这些作者使用了一种mRNA递送系统,类似于COVID-19 mRNA疫苗所用的方法。他们纯化了一种表达靶向GPC2的CAR的mRNA转录本(下称mRNA CAR)。他们使用他们收集的T细胞,然后使用一种称为电穿孔的技术,瞬时打开T细胞的细胞膜并将这种mRNA转录本导入到它们中。他们接着在体外和体内的脑癌模型中测试了这种经过基因改造的T细胞。
这些作者发现他们的mRNA CAR在体外和体内的临床前模型中都能有效地攻击成神经管细胞瘤和高级别胶质瘤。他们的mRNA CAR的表达时间较短---大约5-7天---在临床环境中,这将允许策略性控制剂量。
13.Science子刊:开发出CAR联合筛选方法,确定最有效治疗癌症的CAR-T细胞
doi:10.1126/scitranslmed.abm1463
近年来,经过基因改造的免疫细胞---配备了识别和摧毁肿瘤细胞的分子武器---已经改变了癌症治疗的面貌。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员开发出一种新的方法来比较大量的CAR-T细胞,每种CAR-T细胞的分子特征略有不同,以确定哪种CAR-T细胞对癌症最有效和最持久。相关研究结果发表在2022年11月9日的Science Translational Medicine期刊上,论文标题为“Pooled screening of CAR T cells identifies diverse immune signaling domains for next-generation immunotherapies”。
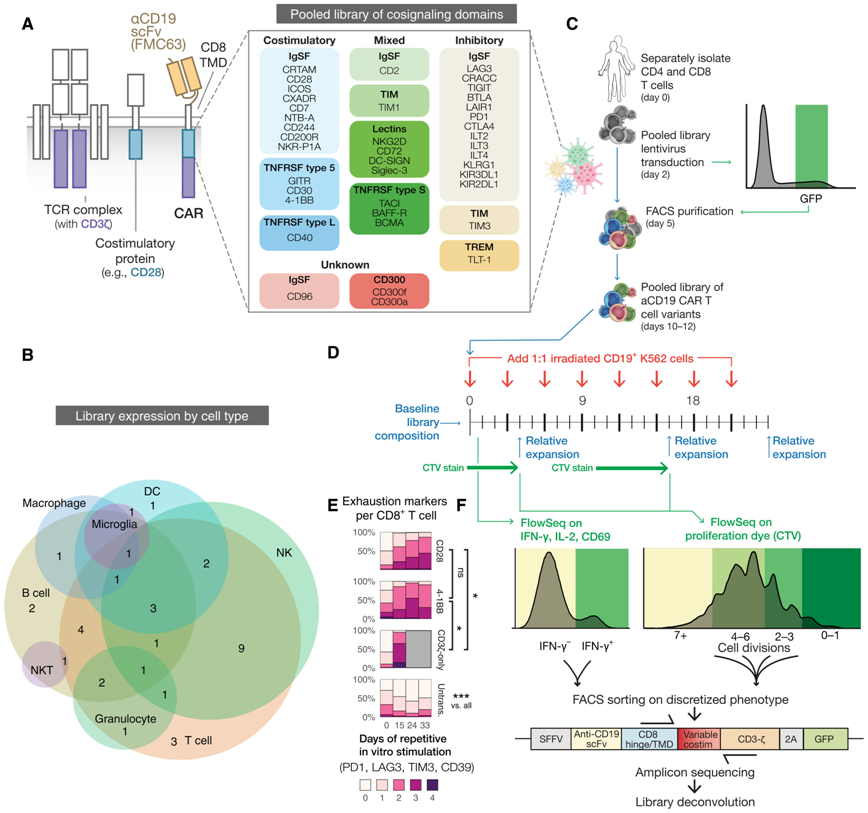
生成和筛选具有不同信号传导结构域的CAR汇集文库。图片来自Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abm1463。
在这项新的研究中,这些作者开发出这种称为CAR联合筛选(CAR Pooling)的方法来研究具有40种不同嵌合抗原受体(CAR)的CAR-T细胞。这种在可以在未来扩大到测试数百或数千种受体组合的筛选发现了新的和令人惊讶的CAR,使这些治疗性CAR-T细胞更加强大。
论文通讯作者、加州大学旧金山分校微生物学与免疫学副教授Kole Roybal博士说,“CAR-T细胞对很多血癌患者来说绝对是一种变革。这项新的研究为以更聪明的方式设计这些细胞以便它们能更好、更持久地发挥作用并用于治疗更多的癌症类型奠定基础。”(生物谷 Bioon.com)
相关生物谷新闻:
CAR-T细胞疗法研究进展(第33期)
https://news.bioon.com/article/c0b4e49733ba.html
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


