近十年来骨髓纤维化新药!百时美施贵宝JAK2抑制剂Inrebic欧盟获批:将成临床新护理标准!
来源:本站原创 2021-02-11 02:01
Inrebic是百时美施贵宝740亿美元收购新基获得,是近10年来首个骨髓纤维化新药。

2021年02月10日讯 /生物谷BIOON/ --百时美施贵宝(BMS)近日宣布,欧盟委员会(EC)已授予Inrebic(fedratinib)完全上市许可,该药是一款高度选择性JAK2抑制剂,用于原发性骨髓纤维化、真性红细胞增多症后骨髓纤维化、原发性血小板增多症骨髓纤维化成人患者,治疗疾病相关脾肿大(脾脏增大)或症状,包括没有接受过JAK抑制剂的患者(JAK抑制剂初治患者)和曾接受过ruxolitinib(Jakavi/Jakafi,鲁索替尼,诺华/Incyte公司口服JAK1/JAK2抑制剂)治疗的患者(JAK抑制剂经治患者)。
值得一提的是,Inrebic是近10年来欧洲第一款治疗骨髓纤维化的新疗法,同时也将是第一款在ruxolitinib治疗失败、对ruxolitinib不耐受的或JAK抑制剂初治的骨髓纤维化患者中显著减少脾脏体积和症状负担的每日一次口服疗法。近十年来,使用ruxolitinib治疗病情进展的骨髓纤维化患者没有治疗方案,这种罕见骨髓疾病的特点是虚弱症状和脾脏肿大。
Inrebic是百时美施贵宝740亿美元收购新基获得。2019年8月,Inrebic获得美国FDA批准,用于中危-2和高危(intermediate-2/high-risk)原发性或继发性(红细胞增多症后或原发性血小板增多症后)骨髓纤维化成人患者的治疗。Inrebic通过FDA的优先审查程序获得批准,之前还被授予了孤儿药资格。此外,Inrebic也获得了加拿大批准。
骨髓纤维化是一种严重的骨髓疾病,会破坏人体正常的血细胞生成。此次批准,使Inrebic成为近十年来美国FDA批准的第一个骨髓纤维化新药,将为患者提供一种新的每日一次的口服治疗选择。2011年,诺华/Incyte公司的JAK1/JAK2抑制剂Jakafi(ruxolitinib,鲁索替尼)获得FDA批准,成为首个治疗骨髓纤维化的药物,该药每日口服2次。

需要注意的是,Inrebic的产品处方信息中附有一则黑框警告,提示严重和致命性脑病(脑损伤或功能失常)的风险,包括韦尼克脑病(Wernicke's)。在临床研究中,接受Inrebic治疗的患者中有1.3%(n=8/608)发生严重脑病,其中0.16%(n=1/608)死亡。韦尼克脑病是由硫胺素(维生素B1)缺乏引起的一种神经急症。所有患者应在启动Inrebic治疗前以及治疗期间周期性地检测硫胺素水平。硫胺素缺乏患者不能启动治疗;治疗开始前应补充硫胺素。如果怀疑有脑病,应立即停止Inrebic治疗并启动肠外硫胺素。监测直到症状消失或改善以及硫胺素水平正常化。
此次批准,基于JAKARTA研究和JAKARTA2研究的结果。这2项研究的调查员、英国伦敦盖伊和圣托马斯国民保健信托基金会血液学教授Claire Harrison医学博士表示:“骨髓纤维化是一种严重的骨髓疾病,通常会使人衰弱,近十年来只有一种被批准的治疗方案。临床数据显示,在接受ruxolitinib治疗病情进展或尚未接受JAK抑制剂治疗的患者中,Inrebic治疗使脾脏体积和症状有临床意义的减少。在欧盟,每年大约每10万人中就有一人被诊断为骨髓纤维化,今天的批准为仍然迫切需要新疗法的患者提供了一个重要的新选择。”
骨髓纤维化-脾脏肿大(图片来源:oncohemakey.com)
Inrebic的开发项目由多项研究(包括III期临床研究JAKARTA和II期临床研究JAKARTA2)组成,共608例患者接受过至少一次治疗(剂量范围:30mg至800mg),其中459例骨髓纤维化患者,包括97例先前接受过Jakafi治疗的患者。
此次欧盟批准,基于JAKARTA研究和JAKARTA2研究的结果。JAKARTA是一项随机、安慰剂对照研究,在289例先前未接受过JAK抑制剂治疗的原发性或继发性骨髓纤维化患者中开展,评估了2种剂量(400mg和500mg)Inrebic相对于安慰剂的疗效和安全性。结果显示:治疗第6周期结束后,Inrebic 400mg剂量组有37%(n=35/96)患者脾脏体积较基线减少≥35%、有40%(n=36/89)患者骨髓纤维化总体症状评分较基线改善≥50%,安慰剂组分别为1%(n=1/96)和9%(n=7/81),数据具有统计学显著差异(均p<0.0001)。
JAKARTA2是一项单臂、开放标签研究,在97例既往已接受过Jakafi治疗的原发性或继发性骨髓纤维化患者中开展,评估了Inrebic(起始剂量400mg)的疗效和安全性。结果显示,Inrebic治疗表现出临床意义的应答率。在意向性治疗(ITT,n=97)患者中,治疗第6个周期结束后,有31%的患者脾脏体积缩小≥35%。这97例患者中,79例(81%)符合更窄的Jakafi耐药或不耐受标准。在该队列中,第个6周期末脾脏体积缩小≥35%的患者比例为30%(95%CI:21,42),与ITT人群中观察到的应答率一致。此外,在ITT群体(95%CI:18,37)以及纳入狭窄标准分析(95%CI:17,39)的患者中,症状缓解率≥50%的患者比例均为27%。
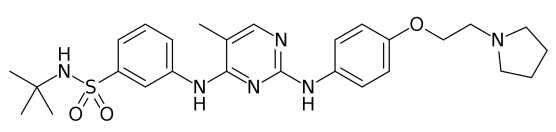
fedratinib分子结构式(图片来源:Wikipedia)
Inrebic的活性药物成分为fedratinib,该药是一种口服激酶抑制剂,对野生型和突变激活的Janus相关激酶2(JAK2)和FMS样酪氨酸激酶3(FLT3)具有活性。fedratinib是一种JAK2选择性抑制剂,与家族成员JAK1、JAK3和TYK2相比,它对JAK2具有更高的抑制作用。JAK2的异常激活与骨髓增生性肿瘤(MPN)有关,包括骨髓纤维化和真性红细胞增多症。
在表达突变激活JAK2或FLT3的细胞模型中,fedratinib可降低信号转导子和转录激活子(STAT3/5)蛋白的磷酸化,抑制细胞增殖,诱导凋亡细胞死亡。在JAK2V617F驱动的骨髓增生性疾病小鼠模型中,fedratinib阻断了STAT3/5的磷酸化,提高了存活率,改善了疾病相关症状,包括白细胞减少、红细胞比容、脾肿大和纤维化。(生物谷Bioon.com)
原文出处:Bristol Myers Squibb Receives European Commission approval for Inrebic® (fedratinib) for Adult Patients with Newly Diagnosed and Previously Treated Myelofibrosis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


