2023年2月Cell期刊精华
来源:生物谷原创 2023-02-28 09:51
2023年2月份即将结束,2月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年2月份即将结束,2月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:首次构建出蝙蝠诱导性多能干细胞,有助于更好了解蝙蝠和病毒之间的密切关系
doi:10.1016/j.cell.2023.01.011
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员首次产生了蝙蝠诱导性多能干细胞(induced pluripotent stem cell, iPSC),对蝙蝠和病毒之间的密切关系有了宝贵的认识。这一结果为研究SARS-CoV-2等病毒如何通过对新宿主的分子适应来生存、传播和逃避免疫系统打开了大门。他们的发现也可能揭示了蝙蝠的独特特性,这些特性是它们对衰老和癌症的卓越防御的基础。相关研究结果于2023年2月21日在线发表在Cell期刊上,论文标题为“Bat pluripotent stem cells reveal unusual entanglement between host and viruses”。
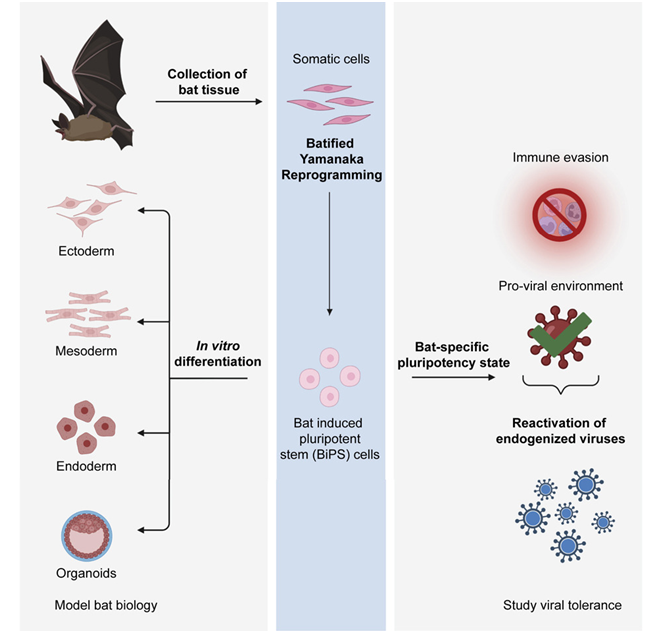
图片来自Cell, 2023, doi:10.1016/j.cell.2023.01.011。
论文共同通讯作者、西奈山伊坎医学院细胞、发育与再生生物学教授Thomas Zwaka博士说,“我们的研究表明,蝙蝠进化出了耐受大量病毒序列的机制,它们与病毒的关系可能比以前想象的更加紧密。鉴于许多蝙蝠物种已被证明能够耐受对人类具有高死亡率的病毒,包括SARS-CoV、SARS-CoV-2、MERS-CoV和马尔堡病毒,并且在它们的感染中存活下来,这就有了新的意义。原因可能是蝙蝠的先天免疫反应受到了调节,这使得它们成为无症状和耐受性的病毒宿主。”
doi:10.1016/j.cell.2023.01.022
在大自然中,当两只动物打架时,它们很少没有观众。将镜头拉回一对发生冲突的狮子,你会看到它们的同伴在观看。
在一项新的研究中,来自美国斯坦福大学的研究人员想知道旁观的动物如何看待这些攻击性的互动。在小鼠中,他们发现大脑中一个称为“激怒中枢(rage center)”的区域中的一些神经元在小鼠打斗时和观看其他小鼠打斗时都会放电。这类神经元被称为镜像神经元(mirror neuron)---当一只动物在做某种行为时,当它看到另一种动物做同样的行为时,这些神经元是活跃的。相关研究结果于2023年2月15日在线发表在Cell期刊上,论文标题为“Hypothalamic neurons that mirror aggression”。
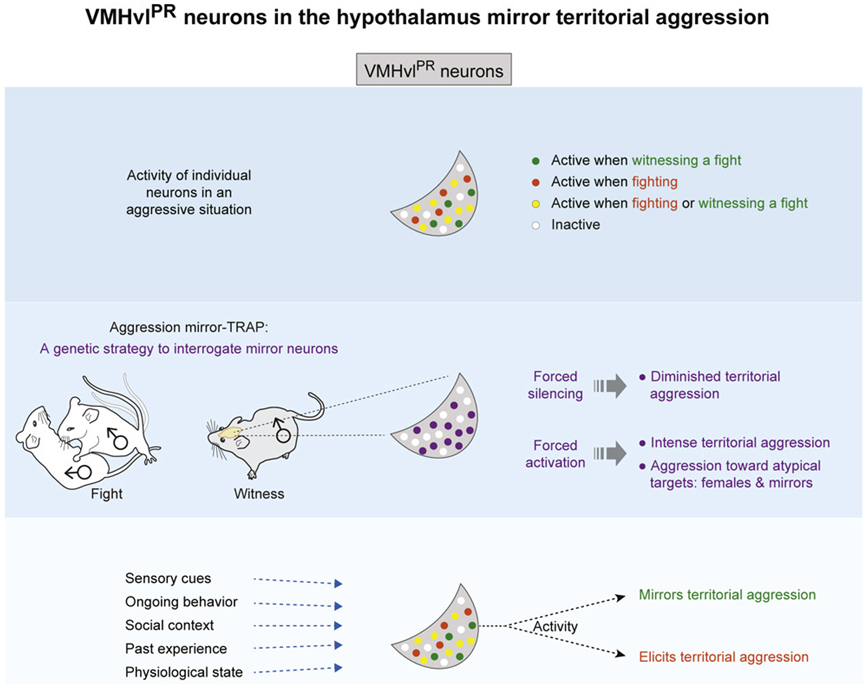
图片来自Cell, 2023, doi:10.1016/j.cell.2023.01.022。
利用精确的成像技术,这些作者记录了参与斗殴的雄性小鼠和目睹打架的雄性小鼠的激怒中枢中的神经元活动。引发雄性小鼠之间的争斗很简单---他们只需将一只雄性小鼠引入另一只雄性小鼠的笼子。住在笼子里的雄性小鼠会攻击入侵者,并表现出威胁性行为,如尾巴摇动。为了设置见证者,他们让一只孤独的老鼠通过一个透明的隔板来观察这些争斗。他们发现,激怒中枢中的一组几乎相同的神经元在参与斗殴的雄性小鼠(下称斗殴小鼠)和观察它们斗殴的雄性小鼠(下称观察小鼠)中都很活跃---这使它们成为镜像神经元。
另一个吃惊的发现是,在观察小鼠身上,攻击性镜像神经元(aggression-mirroring neuron)是由视觉触发的,而在斗殴小鼠身上,它们是由信息素的气味触发的。录像显示镜像神经元只在观察小鼠面对斗殴小鼠的时刻才放电,而不是在其转身离开的时候。当这些作者关闭灯光时,观察小鼠的镜像神经元对隔壁的斗殴完全没有反应。
他们还发现,这些镜像神经元似乎天生就适应攻击,即使是那些从未目睹或参与过攻击性行为的小鼠。当小鼠观察其他行为(比如,嗅觉、梳理或在轮子上跑步)时,这些镜像神经元并不放电。
3.Cell:新研究揭示细胞中H2A-H2B介导的表观遗传记忆机制
doi: 10.1016/j.cell.2023.01.007
由于细胞随着时间的推移会失去重要的信息,科学家们想了解细胞是如何复制它们的信息的。如果科学真地了解了这一点,我们就能让细胞比现在更好地自我保存,并能够减缓衰老,甚至可能对抗癌症。
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现了一种未知的机制,即细胞在分裂时如何“记住”自己的身份,即细胞所谓的表观遗传记忆。相关研究结果于2023年2月6日在线发表在Cell期刊上,论文标题为“Recycling of modified H2A-H2B provides short-term memory of chromatin states”。
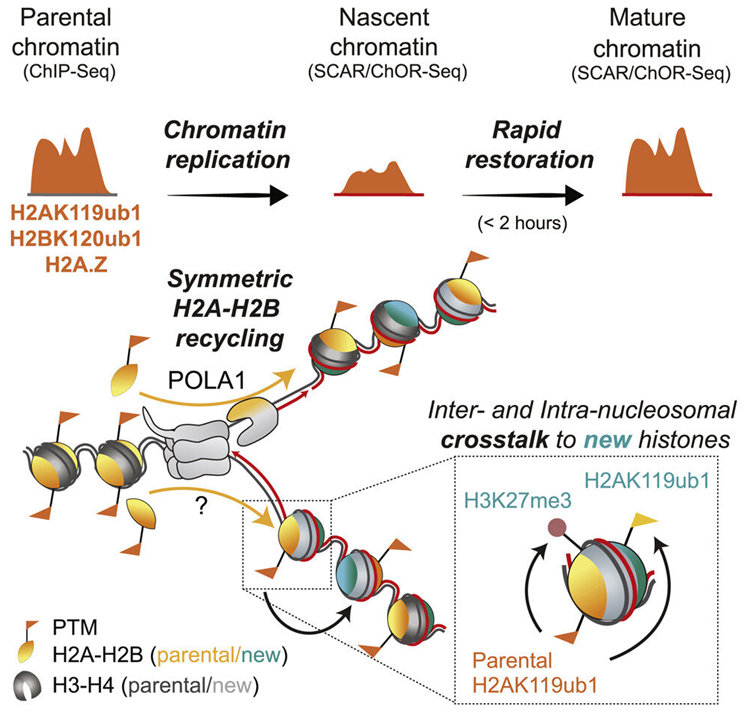
图片来自Cell, 2023, doi: 10.1016/j.cell.2023.01.007。
论文通讯作者、哥本哈根大学诺和诺德基金会蛋白质研究中心的Anja Groth教授说,“一旦我们完全理解这一机制,它可能有助于对抗癌症和衰老。这是一个惊人的复杂网络的一部分,该网络的作用是维持我们身体中每个细胞的功能。如果我们破坏这一机制,我们可以使细胞忘记它们的身份,这可能有助于将它们变成其他细胞类型,这在再生医学中是很有用的。”
Groth说,“既然我们发现了这个新的调节水平,下一步就是要详细了解它,并描述它的全部生理作用。因为在靶向或改变任何细胞过程之前,我们首先需要从分子上了解它是如何工作的。在这项新的研究中,我们正在为调节细胞复制表观遗传景观的方式铺上第一块砖。人们已在表观基因组编辑方面投入了巨大的努力,而且表观遗传年轻化是一个新兴的热门话题,我们的研究将为这些正在进行的发展提供支持。”
4.Cell:为何即使是同卵双胞胎也有不同的指纹?新研究揭示指纹形成之谜
doi:10.1016/j.cell.2023.01.015
在一项新的研究中,来自英国爱丁堡大学、赫瑞瓦特大学、牛津大学、卡迪夫大学、杜伦大学、中国科学院上海营养与健康研究所、复旦大学和捷克理工大学的研究人员研究了小鼠和人类的指纹产生,从而揭示了独特的指纹形成过程。相关研究结果于2023年2月9日在线发表在Cell期刊上,论文标题为“The developmental basis of fingerprint pattern formation and variation”。
之前对指纹的研究已表明,它们的目的是提供额外的抓力和提高灵敏度。科学家们和普通人很早就知道,在人类中,它们是独一无二的---即使是同卵双胞胎也有不同的指纹。为什么会出现这种情况一直是个谜。在这项新的研究中,这些作者解开了这个谜团。
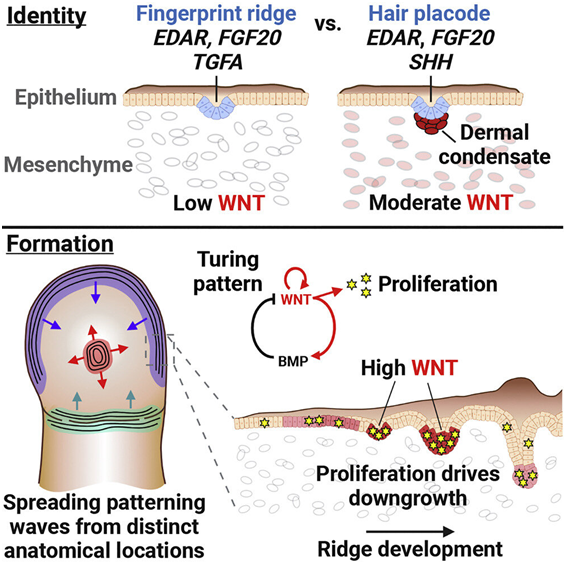
图片来自Cell, 2023, doi:10.1016/j.cell.2023.01.015。
为了更好地了解指纹是如何形成的,以及为什么它们在人与人之间有所不同,这些作者追踪了它们在胚胎小鼠中的形成,并研究了它们形成背后的遗传学。他们发现了所谓的图灵反应-扩散系统(Turing reaction-diffusion system)。
通过观察胚胎小鼠(和培养皿中的人类细胞)的指纹形成情况,这些作者可以观察到在手指末端的三个不同部分---指尖、中心和最接近顶部指节的部分---中,脊(ridge)形成并相互作用。当不同的细胞群体相对于它们的物理位置相互推挤时,出现了旋涡状的图案。
当细胞相互推挤形成脊时,手指在子宫中的随机位置是使得这些图案如此随机的原因。这就是为何即使是同卵双胞胎也有不同的指纹。这些作者还发现,指纹形成的初始阶段与毛囊的发育阶段几乎相同。唯一的区别是,在毛囊中,皮肤表面以下更深的细胞参与了这一过程。
doi:10.1016/j.cell.2023.01.016
在一项新的研究中,来自美国哥伦比亚大学等研究机构的研究人员首次揭示了一种生死攸关的蛋白的三维结构,其清晰度足以最终揭示它是如何起作用的:就像一艘载着分子乘客的微型渡轮,它必须穿越从肾脏和大脑到内耳和肺泡等组织和器官中近万亿个细胞的细胞膜。相关研究结果发表在2023年2月16日的Cell期刊上,论文标题为“Structures of LRP2 reveal a molecular machine for endocytosis”。
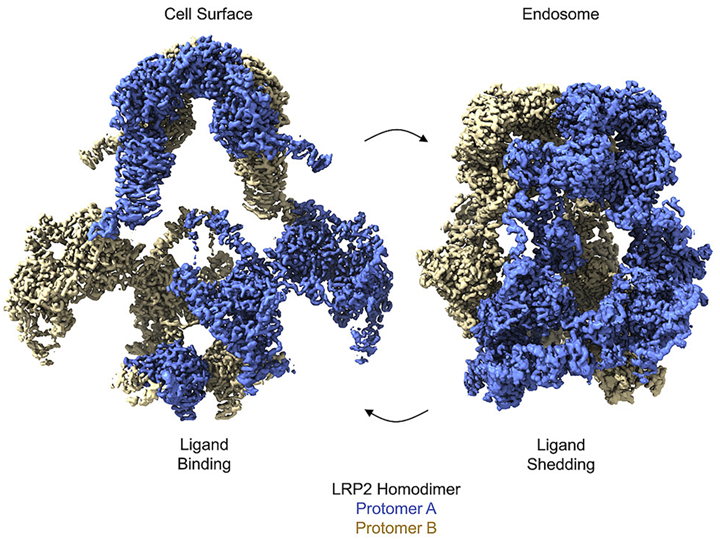
图片来自Cell, 2023, doi:10.1016/j.cell.2023.01.016。
这种称为LRP2的蛋白是在从线虫到人类的多种生物中发现的LRP蛋白质家族的成员。与细胞膜上的大多数蛋白相比,LRP是巨大的,以至于在20世纪80年代初发现LRP2的科学家Marilyn Farquhar和Dontscho Kerjaschki将它称为megalin。一些LRP是由4600多个氨基酸构建而成的。
论文共同通讯作者、哥伦比亚大学瓦格洛斯内外科医生学院的Jonathan Barasch博士说,“随着对这一关键蛋白的新的机理理解,以及它的突变如何使它关闭,我们希望后续研究将发现治疗肾脏和大脑疾病的新靶标。我在哥伦比亚大学的同事Andrew Beenken、Anthony Fitzpatrick和Lawrence Shapiro发现了令人惊奇的这些蛋白结构,这是开发新疗法的突破口。”
Barasch博士和他的合作者们设想,这些新的高分辨率蛋白结构将指向治疗疾病的线索,如急性肾损伤(每年影响美国400多万患者)、慢性肾脏病(影响全球约8亿人)和阿尔茨海默病(估计影响全球3200万人)等流行疾病,以及像唐奈-巴罗综合征(Donnai-Barrow syndrome,影响不到1000名美国人)这样罕见的、具有多种身体和认知后果的遗传疾病。
doi:10.1016/j.cell.2023.01.020
身体不断地用新的红细胞和白细胞补充血液,这要归功于一个名为造血干细胞(HSC)的小而重要的细胞群体。如今,在一项新的研究中,来自美国布罗德研究所、波士顿儿童医院和达纳-法伯癌症研究所的研究人员发现人类造血干细胞特别容易受到铁死亡(ferroptosis)---一种由铁引发的细胞死亡---的影响。相关研究结果发表在2023年2月16日的Cell期刊上,论文标题为“Human hematopoietic stem cell vulnerability to ferroptosis”。
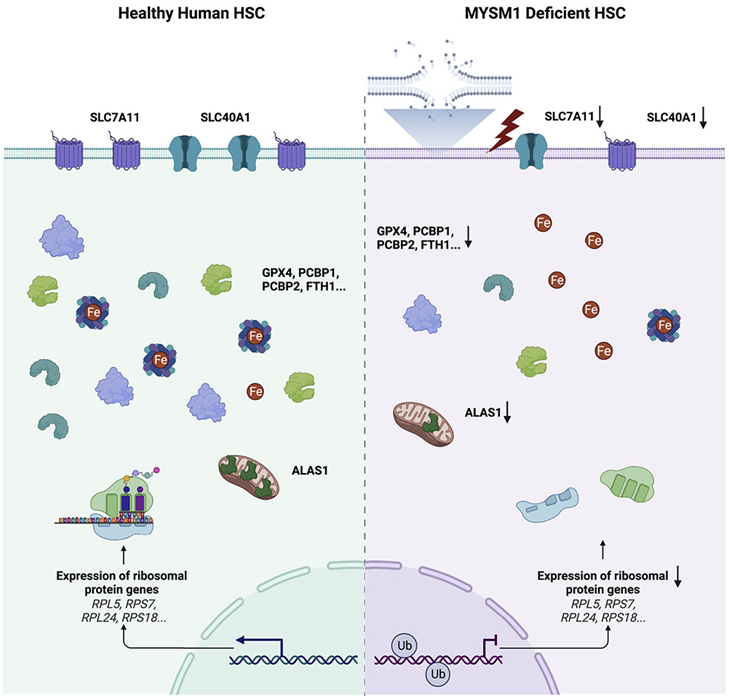
图片来自Cell, 2023, doi:10.1016/j.cell.2023.01.020。
科学家们主要在癌细胞中研究铁死亡,然而这项新的研究是首次发现正常细胞类型也容易受到这种形式的细胞死亡的影响。这一研究结果还指出了正在开发的促进铁死亡以杀死癌细胞的药物的潜在副作用。他们还提出了治疗由造血干细胞水平低下引起的血液疾病的新策略。
这些作者首先在一种罕见的骨髓疾病中发现了造血干细胞的这种铁死亡易感性,但是惊讶地发现健康的造血干细胞也有这种特征。他们还发现,这种易感性源于这些细胞的蛋白生产速度下降。
论文通讯作者、布罗德研究所研究员Vijay Sankaran说,“这是一个很好的例子,一种罕见疾病可以教会我们更多关于基本生物学过程的知识,否则我们不会发现这些知识。这确实强化了为什么研究罕见疾病可以教会我们一些有广泛价值的东西。”
7.Cell和Cell子刊为开发对所有ALS患者广泛有效的疗法指明方向
doi:10.1016/j.stem.2023.01.005; doi:10.1016/j.cell.2023.01.005
在美国,每年有5000名患者被诊断为肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis, ALS),这是一种无法治愈的神经退行性疾病,可能会在两到五年内致命。在为这些患者寻找治疗方法的过程中,由美国南加州大学干细胞科学家Justin Ichida领导的一个研究团队在两项新的研究中确定了两条有希望的途径,为这种毁灭性疾病的不同形式开发新的治疗方法。他们的研究结果发表在2023年2月2日的Cell Stem Cell期刊和2023年2月7日的Cell期刊上,论文标题分别为“SYF2 suppression mitigates neurodegeneration in models of diverse forms of ALS”和“PIKFYVE inhibition mitigates disease in models of diverse forms of ALS”。
作为这两篇论文的共同第一作者、Ichida实验室的博士后Gabriel Linares说,“少数患者患有ALS的多种遗传原因,这些遗传原因可以在家族内遗传,大多数患者患有所谓的‘散发性’疾病,因为其病因尚不清楚。这使得找到一种对所有ALS患者都有效的治疗方法成为一项艰难的挑战。”
在第一项新的研究中,Linares和论文共同第一作者、Ichida实验室博士后Yichen Li发现一些最有效的药物和药物类分子可以增加雄激素的活性,雄激素是包括睾酮在内的一组众所周知的性激素。然而,由于促进雄激素的药物可能对ALS患者产生不良或不安全的副作用,他们旨在确定一种可能产生类似结果的基因变化。
为了实现这一目标,他们利用了布罗德研究所开发的公共生物信息学数据库,即Connectivity Map。通过分析这个关于药物如何影响疾病的遗传景观的庞大数据库,他们准确地预测,抑制SIF2基因将提高来自不同形式ALS患者的运动神经元的存活率。此外,抑制该基因可减少ALS小鼠的神经变性、运动功能障碍和其他症状。
在第二项新的研究中,Linares和论文共同第一作者、Ichida实验室博士生Shu-Ting (Michelle) Hung详细说明了抑制一种蛋白---PIKFYVE激酶---可能代表另一种治疗许多不同形式ALS的有效策略。
在一系列广泛的实验中,这些作者在果蝇、线虫、小鼠和来自不同形式ALS患者的运动神经元中使用药物阿吡莫德(apilimod)以及通过基于基因和RNA的方法来抑制PIKFYVE。他们发现,抑制PIKFYVE可以通过胞吐过程(exocytosis)刺激运动神经元清除有毒蛋白,从而减少神经退行性变,改善运动功能,延长寿命,其中在胞吐过程中,膜包围的囊包裹并主动将废物运输到细胞外。
doi:10.1016/j.cell.2022.12.028
如今,在一项新的研究中,来自美国哈佛医学院的一个研究团队将组织学与前沿的单细胞成像技术相结合,构建出大规模的结直肠癌二维和三维空间图谱。这些图谱在组织学特征之上叠加了大量的分子信息,以提供关于癌症结构的新信息,以及它如何形成、进展和与免疫系统相互作用。相关研究结果近期发表在Cell期刊上,论文标题为“Multiplexed 3D atlas of state transitions and immune interaction in colorectal cancer”。

图片来自Cell, 2023, doi:10.1016/j.cell.2022.12.028。
论文通讯作者、哈佛医学院布拉瓦特尼克研究所系统药理学教授Peter Sorger说,“我们的方法为150年的病理诊断提供了一个分子窗口---揭示了许多传统上被认为是孤立的元素和结构实际上是以意想不到的方式相互关联的。一个比喻是,以前我们只是在看大象的尾巴或脚,但如今,我们第一次可以开始一次看到整头大象。”
这些图谱是Sorger及其研究团队更广泛的努力的一部分,即为不同的癌症类型构建图谱,作为美国国家癌症研究所人类肿瘤图谱网络的一部分,将免费提供给科学界。此前,他们使用类似的方法构建了早期黑色素瘤的深度图谱,其他癌症的图谱也已在开发中。最终,他们希望这些癌症图谱将推动研究,并改善诊断和治疗。
9.Cell:在单细胞分辨率下揭示小鼠大脑衰老的分子和空间特征
doi:10.1016/j.cell.2022.12.010
在一项新的研究中,来自美国哈佛大学的研究人员的新发现为我们提供了炎症与随着年龄增长而经历的认知障碍之间的关系的新见解,并表明这可能是一种细胞链式反应的结果。相关研究结果近期发表在Cell期刊上,论文标题为“Molecular and spatial signatures of mouse brain aging at single-cell resolution”。
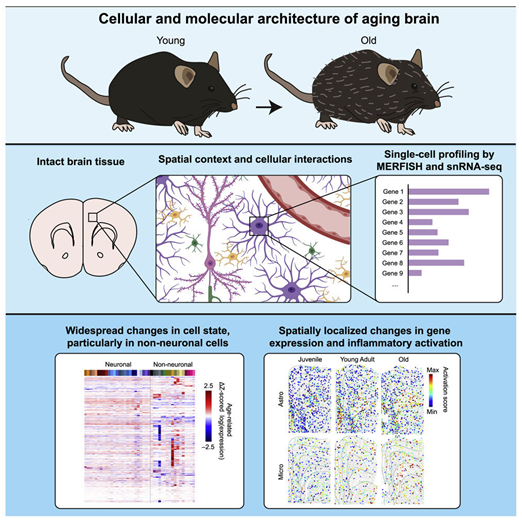
图片来自Cell, 2023, doi:10.1016/j.cell.2022.12.010。
论文共同通讯作者、哈佛大学化学与化学生物学系教授庄小威(Xiaowei Zhuang)说,“了解衰老是生物医学中最重要的目标之一。这也是一个非常具有挑战性的问题。一个原因是大脑非常复杂。它包含非常高的细胞多样性,许多不同类型的神经元和非神经元细胞形成了复杂的相互作用网络。”
为了研究这样一种复杂的系统,这些作者使用了一种名为MERFISH的成像方法,该方法由Zhuang实验室开发。MERFISH(Multiplexed Error Robust Fluorescence In Situ Hybridization,多重误差稳健荧光原位杂交)不仅能够同时测量细胞中数千种RNA或数千种基因,还可以揭示它们之间的空间关系。
论文共同通讯作者、哈佛大学分子与细胞生物学系教授Catherine Dulac解释说,MERFISH使得科学家们能够生成“基因表达图谱”,研究细胞之间的“邻居关系”。Dulac说,通过MERFISH,“我们不仅可以观察不同年龄的基因表达的变化,还可以观察基因表达的变化,特别是与它们的空间关系有关的细胞类型。”
10.Cell:科学家揭示光调节机体代谢过程背后的神经分子机制
doi:10.1016/j.cell.2022.12.024
研究表明,人造光(artificial light)是引发机体代谢紊乱的一种高风险因素,然而,光调节机体代谢背后的神经机制,目前研究人员并不清楚。近日,一篇发表在国际杂志Cell上题为“Light modulates glucose metabolism by a retina-hypothalamus-brown adipose tissue axis”的研究报告中,来自中国科学技术大学等机构的科学家们通过研究揭示了光感受抑制棕色脂肪组织(BAT)产热的神经分子机制,从而就会降低小鼠和人类机体中的葡萄糖耐受(GT)。
此前研究结果表明,光是诱发机体代谢紊乱的一种实质性因素,然而,光对机体代谢的调节是否是直接的还是通过昼夜节律的干扰仍然是未知的,此外,参与光调节机体葡萄糖代谢的特殊过程和神经回路,还有待于科学家们进一步研究阐明。为了阐明这些问题,研究者Xue Tian等人首先对小鼠和人类进行了葡萄糖耐受性的测试,结果发现,其机体的葡萄糖耐受水平在光照下会明显降低;除了介导视觉感知的椎体和杆状体外,光还能直接激活内在的光敏视网膜神经节细胞(ipRGCs,photosensitive retinal ganglion cells),这些细胞支配着很多大脑区域并能调节诸如昼夜节律钟等功能,为了确定哪类光感受器能介导光所诱导的葡萄糖不耐受,研究人员逐个失活了不同类型的光感受器,结果发现其或许仅仅是由ipRGCs所介导的。
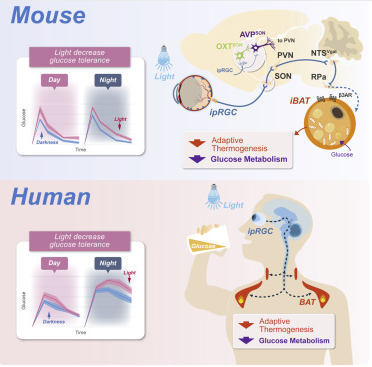
科学家揭示光调节机体代谢过程背后的神经分子机制。图片来源:Cell (2023). DOI:10.1016/j.cell.2022.12.024
为了确定是否葡萄糖不耐受是由光诱导的昼夜节律干扰或通过神经回路的直接光调节所引起的,研究人员利用兴奋性病变分别探测了中央昼夜节律器(SCN,central circadian pacemaker)和下丘脑视上核(SON,hypothalamus supraoptic nucleus),从而就观察到其在导致葡萄糖耐受性下降上都表现出了各自的贡献,研究结果表明,光诱导的葡萄糖不耐受或许是由ipRGC-SON通路所介导的,与昼夜节律相位无关。研究人员还进一步利用神经回路追踪技术发现了ipRGC-SON-PVN-NTS-Rpa通路或能介导光诱导的葡萄糖不耐受性。
随后研究人员进一步分析了参与机体葡萄糖代谢的光诱导的激素和营养物质的改变,葡萄糖代谢包括胰岛素、胰高血糖素和胰高血糖素样肽-1,结果发现,其依然能保持不变。因此,光并不会干扰糖原的合成和分解,此外研究人员还发现血液中的乳酸、非酯化脂肪酸和其它氨基酸的水平并未发生改变,这就消除了光抑制血糖向脂肪和氨基酸转化的可能性。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


