2019年5月Cell期刊不得不看的亮点研究
来源:本站原创 2019-05-31 23:59
2019年5月31日讯/生物谷BIOON/---2019年5月份即将结束了,5月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:我国科学家揭示人FcRn是B族肠道病毒的细胞脱衣壳受体doi:10.1016/j.cell.2019.04.035在一项新的研究中,中国科学院微生物研究所的高福(George F. Gao)课题组、北京大学的魏文胜(Wensheng
2019年5月31日讯/生物谷BIOON/---2019年5月份即将结束了,5月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:我国科学家揭示人FcRn是B族肠道病毒的细胞脱衣壳受体
doi:10.1016/j.cell.2019.04.035
在一项新的研究中,中国科学院微生物研究所的高福(George F. Gao)课题组、北京大学的魏文胜(Wensheng Wei)课题组和首都医科大学附属北京儿童医院的谢正德(Zhengde Xie)课题组发现人新生儿Fc受体(human neonatal Fc receptor, FcRn)是主要的B族肠道病毒的脱衣壳受体。相关研究结果于2019年5月16日在线发表在Cell期刊上,论文标题为“Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B”。
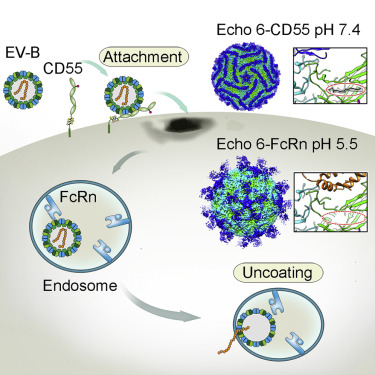
这些研究人员发现FcRn通过它的FCGRT亚基与B族肠道病毒颗粒表面上的“峡谷”(Canyon)样结构部位结合。
通过在原子或近原子分辨率下在病毒进入宿主细胞的不同阶段获得多种低温电镜结构,这些研究人员破解了肠道病毒附着和脱衣壳的内在机制。这些结构揭示了与附着受体CD55不同的是,FcRn与B族肠道病毒颗粒颗粒的结合诱导了在酸性条件下“口袋因子(pocket factor)”的高效释放,并启动了病毒颗粒的构象变化,这为理解肠道病毒进入机制提供了结构基础。
2.Cell:我国科学家揭示基孔肯雅病毒入侵宿主细胞机制
doi:10.1016/j.cell.2019.04.008
在一项新的研究中,中国科学院北京生科院、微生物研究所高福(George F. Gao)课题组和中国科学院天津工业生物技术研究所、遗传与发育生物学研究所Feng Gao课题组解析出小鼠MXRA8、人MXRA8与基孔肯雅病毒E蛋白结合在一起时的晶体结构,以及人MXRA8和基孔肯雅病毒样颗粒的低温电镜结构。相关研究结果近期在线发表在Cell期刊上,论文标题为“Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein”。
这些研究人员发现蛋白受体MXRA8拥有两个具有独特拓扑结构的Ig样结构域。这种受体结合到基孔肯雅病毒颗粒表面三聚体刺突蛋白的两个E蛋白单体之间的“峡谷(canyon)”中。在基孔肯雅病毒E蛋白和MXRA8之间的结合界面的原子细节揭示出MXRA8的这两个Ig样结构域和连接这两个结构域的铰链区参与与来自基孔肯雅病毒的E1-E2蛋白氨基酸残基之间的相互作用。此外,MXRA8的茎部区(stalk region)对基孔肯雅病毒入侵宿主细胞至关重要。
这些发现为开发针对这些致关节炎甲病毒的治疗对策提供了重要信息。它们有助于筛选实验药物,评估实验性疫苗产生的抗体是否有可能预防感染,并分析病毒中的突变是否会影响它们的毒力。
3.Cell:挑战现有理论!揭示卵母细胞中促进细胞质与卵黄分离的机制
doi:10.1016/j.cell.2019.04.030
在早期鱼胚中卵黄与周围细胞质的分离是仔鱼(fish larva)发育的关键过程。在一项新的研究中,为了确定它的内在机制,来自奥地利科学技术研究所的研究人员发现细胞中的大量肌动蛋白动力学特性促进斑马鱼卵母细胞的相分离。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Bulk Actin Dynamics Drive Phase Segregation in Zebrafish Oocytes”。
在受精后不到两小时内,单细胞鱼卵就会演变成多细胞胚胎。在这两个小时内,后来形成动物体的细胞质必须与卵黄完全分离。以前,细胞生物学家已提出在卵的一极处的细胞表面局部扩张介导了这种分离。但是,缺乏支持这种模式的直接证据。
为了理解这种分离过程的物理基础,发育生物学家Carl-Philipp Heisenberg研究团队的Shayan Shamipour博士生与理论物理学家Edouard Hannezo的研究团队携手合作。基于这两个研究团队的综合专业知识,这些研究人员揭示出在细胞表面施加的力对于这一过程并不是必需的---这就与之前的模型相反。相反,他们发现在胚胎内部的拉力和推力共同作用下,卵黄颗粒(yolk granule)与细胞质更容易分离开来。重要的是,这种用于描述这一过程的理论可以应用于由于可动流体施加的力引起的任何分离,因此也可能用于探究哺乳动物/人类胚胎中的类似过程。
4.Cell:不育治疗新靶标!揭示EFCAB9引导精子进入卵子机制
doi:10.1016/j.cell.2019.03.047
当精子通过它们的尾巴上的一系列钙离子通道检测到环境变化时,它们就开始向卵子冲刺。在一项新的研究中,来自美国耶鲁大学等研究机构的研究人员鉴定出一种关键分子,它协调这些钙离子通道开启和关闭,从而激活精子并协助引导它们进入卵子。当通过基因编辑移除编码这种分子的基因时,雄性小鼠让更少的雌性小鼠怀孕,而且怀孕的雌性小鼠产生较少的幼仔。他们报道,这些经过基因编辑的雄性小鼠的精子活力较低,并且在实验室中让较少的卵子受精。相关研究结果近期在线发表在Cell期刊上,论文标题为“Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility”。
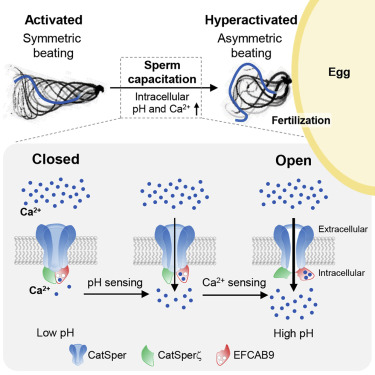
论文通讯作者、耶鲁大学医学院细胞与分子生理学助理教授Jean-Ju Chung说道,这种称为CatSper的钙离子通道复合物在精子尾部排列着。它在许多物种中在进化上是保守的,由多个亚基组成,但是“我们不知道每个亚基发挥的作用是什么”。
先前的研究未能确定CatSper的确切机制,该机制允许精子对女性生殖道的酸性水平等线索做出反应,并触发精子运动的变化,以便更好地导航到卵子。Chung实验室筛选了所有精子蛋白,以鉴定出哪些精子蛋白与钙离子通道复合物CatSper相互作用。他们专注于一种称为EFCAB9的精子蛋白,它作为一个传感器,根据环境线索协调这些钙离子通道的开启和关闭。
5.Cell:新的HIV疫苗递送策略可增强保护性的免疫反应
doi:10.1016/j.cell.2019.04.012
在一项新的研究中,来自美国斯克里普斯研究所、拉霍亚免疫学研究所和加州大学圣地亚哥分校等研究机构的研究人员报道一种新的HIV疫苗递送策略似乎在临床前模型中增强保护性的免疫反应。他们发现连续几天小剂量接种HIV疫苗要比一次性接种全部剂量的相同疫苗诱导更强的免疫反应。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Slow Delivery Immunization Enhances HIV Neutralizing Antibody and Germinal Center Responses via Modulation of Immunodominance”。
一种类似的逐步增加疫苗接种剂量的方法在未来的临床试验中可能是一种递送HIV疫苗的最佳方式。论文通讯作者、拉霍亚免疫学研究所疫苗发现部门Shane Crotty教授说道,“这篇论文展示了这种方法的力量。”
对这项新研究而言,Crotty和他的同事们比较了三种疫苗剂量策略,以便观察是否有更好的机会促使中和抗体产生。来自美国耶基斯国家灵长动物研究中心的研究合作者在恒河猴中测试了这些策略,其中恒河猴是一种研究人体免疫系统如何应对HIV的最佳动物模型。
这些研究人员测试了三种疫苗接种策略:一种传统的疫苗,其中这种疫苗是一次性注射;一种“渗透泵(osmotic pump)”策略,在这种策略中,植入物有点像定时释放的药丸缓慢地递送疫苗;一种逐步增加剂量的策略,在这种策略中,动物每隔一天给予部分剂量的疫苗,持续12天。
正如Crotty所说,传统的疫苗导致了一种可预测的“糟糕”的免疫反应,这种免疫反应以非中和性抗体为主。这项实验随后变得有趣。令所有人吃惊的是,后面两种缓慢释放的策略不仅导致更多的抗体,而且导致更好的抗体产生。
6.Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂
doi:10.1016/j.cell.2019.04.009
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员发现酿脓链球菌Cas9(SpCas9)的首批小分子抑制剂能够更精确地控制基于CRISPR-Cas9的基因组编辑。具体而言,他们通过开发一系列高通量生物化学分析方法和基于细胞的分析方法,筛选了许多小分子 ,以便鉴定出能够破坏SpCas9与DNA结合因而干扰它的DNA切割能力的化合物。这些首批小分子CRISPR-Cas9抑制剂很容易进入细胞,并且比之前发现的抗CRISPR蛋白小得多。这些新化合物可以对基于SpCas9的编辑技术进行可逆的和剂量依赖性的控制,包括它们在哺乳动物 细胞中进行基因编辑、碱基编辑和表观遗传编辑的应用。相关研究结果发表在2019年5月2日的Cell期刊上,论文标题为“A High-Throughput Platform to Identify Small-Molecule Inhibitors of CRISPR-Cas9”。
论文通讯作者、布罗德研究所的Amit Choudhary说道,“这些技术为快速鉴定和使用针对SpCas9和下一代CRISPR相关核酸酶的小分子抑制剂奠定了基础。靶向CRISPR相关核酸酶的小分子抑制剂具有广泛应用于基础研究、生物医学和国防研究以及生物技术应用的潜力。”
7.Cell:我国科学家揭示环状RNA在先天免疫中起着重要作用
doi:10.1016/j.cell.2019.03.046
在真核生物中,共价闭合的环状RNA(circular RNA, circRNA)是由前体mRNA反向剪接数千个基因的外显子产生的。它们通常低水平表达,并经常表现出细胞类型特异性和组织特异性模式。鉴于circRNA的环状构象与线性mRNA对应物的序列重叠,对它们(特别是它们的功能)的研究充满挑战性。
在一项新的研究中,来自中国科学院和上海交通大学的研究人员发现大多数被研究的circRNA倾向于在分子内形成长16~26bp的不完美的RNA双链体(dsRNA)。此外,circRNA优先结合dsRNA激活的蛋白激酶(PKR),并且起着PKR抑制剂的作用。相关研究结果发表在2019年5月2日的Cell期刊上,论文标题为“Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity”。论文通讯作者为中国科学院生物化学与细胞生物学研究所的陈玲玲(Ling-Ling Chen)研究员、中科院-马普学会计算生物学伙伴研究所的杨力(Li Yang)研究员和上海交通大学医学院附属仁济医院的沈南(Nan Shen)研究员。
鉴于circRNA在正常条件下在被研究的细胞和组织中是稳定的,这些研究人员试图确定它们是否能够在某些类型的细胞应激下遭受降解。他们发现poly(I:C)和脑心肌炎病毒(EMCV)dsRNA都能够在病毒感染时通过激活的RNase L触发全局性的circRNA降解。
有趣的是,虽然circRNA和线性RNA都被RNase L降解,但陈玲玲课题组的早期研究已表明新生circRNA的产生很少见。因此,从前体mRNA产生的新生circRNA的数量并不能够克服早期先天免疫反应后RNase L在短时间内对它们的快速降解。这导致circRNA的全局性丧失和circRNA相关PKR的随后释放,因而允许PKR激活。
PKR由dsRNA直接激活,并在对dsRNA的细胞质反应中起重要作用。为了了解circRNA如何与PKR结合并调节它的激活,这些研究人员对通过引物延伸与突变分析测试方法分析的选择性2'-羟基酰化反应(selective 2'-hydroxyl acylation analyzed by primer extension and mutational profiling, SHAPE-MaP)进行了优化,发现大多数被研究的circRNA倾向于形成长16~26 bp的不完美的RNA双链体,所形成的RNA双链体在细胞中作为PKR抑制剂发挥作用。这表明RNase L对circRNA的大量和快速降解是PKR在先天免疫反应早期阶段的激活所必需的。
8.Cell:揭示肿瘤起始干细胞导致癌症在免疫治疗后复发
doi:10.1016/j.cell.2019.03.025
作为一种利用身体的免疫系统抵抗癌症的策略,免疫疗法极大地改善了患者的预后。但是,与许多其他的癌症治疗一样,免疫疗法的一个挥之不去的问题是癌症复发。在许多情况下,肿瘤复发了,但是医生并不知道其中的原因。
如今,在一项新的研究中,来自美国洛克菲勒大学等研究机构的研究人员鉴定出阻止免疫疗法的肿瘤细胞,并对它们如何做到这一点提出了新的见解。相关研究结果于2019年4月25日在线发表在Cell期刊上,论文标题为“Adaptive Immune Resistance Emerges from Tumor-Initiating Stem Cells”。论文通讯作者为洛克菲勒大学的Elaine Fuchs教授。
在这项新的研究中,论文第一作者、Fuchs实验室博士后研究员Yuxuan Miao及其同事们培育出患有一种鳞状细胞癌的小鼠,它们对免疫疗法反应良好。利用这种癌症小鼠模型,他们发现一部分称为肿瘤起始干细胞的癌细胞通过产生一种称为CD80的分子在这种治疗中存活下来,这种分子位于这些癌细胞的表面上并抑制体内旨在根除这种癌症的免疫细胞的有效性。
Fuchs团队还鉴定出一种首先触发这些肿瘤起始干细胞产生CD80的分子开关,即一种称为TGFβ的蛋白,这就为改进免疫疗法提供了潜在的新途径。比如,阻断TGFβ的抗体可能潜在地与常规的免疫疗法联合使用来克服这种抵抗性问题。
9.Cell:在世界海洋中发现将近20万种病毒群体
doi:10.1016/j.cell.2019.03.040
在一项新的研究中,来自美国、法国、瑞士、意大利、荷兰、加拿大、德国、英国、比利时和俄罗斯的研究人员报道世界海洋的病毒多样性比之前报道的要大得多。他们基于对146份海水样本的DNA分析,发现了将近20万种病毒群体。相关研究结果于2019年4月25日在线发表在Cell期刊上,论文标题为“Marine DNA Viral Macro- and Microdiversity from Pole to Pole”。
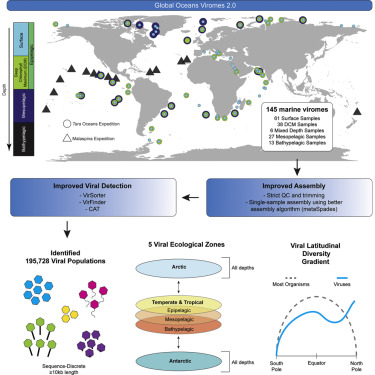
这些研究人员在包括北冰洋和南冰洋在内的一系列探险中收集了来自将近80个地点的海水样本。他们指出,鉴于在将病毒定义为物种方面存在着争议,因此这项新的研究将病毒描述为群体。这些病毒群体可以分为五类:北冰洋、南冰洋、温带和热带海洋上层(temperate and tropical epipelagic, 水面以下200米)、海洋中层(mesopelagic, 水面以下200至1000米)和海洋深层(水面以下1000至4000米)。
科学家们对病毒在海洋生态系统中的作用很感兴趣。之前针对病毒的研究已报道海洋病毒在促进细菌和藻类死亡方面起着关键作用,这可能反过来影响海洋生产力。论文共同第一作者、美国俄亥俄州立大学的Ahmed Zayed表示,“病毒控制着微生物群落的结构,以及它们的进化轨迹。”
10.Cell:活性更强的长寿基因SIRT6意味着更长的寿命?
doi:10.1016/j.cell.2019.03.043
几个世纪以来,探险家们一直梦想着能有不老泉,它的泉水具有治疗作用,能使老年人恢复活力,并无限期地延长寿命。然而,在一项新的研究中,来自美国罗切斯特大学的研究人员发现了更多的证据表明长寿的关键在于一个称为SIRT6的基因。他们发现基因SIRT6在具有更长寿命的物种中负责更高效的DNA修复。这一发现揭示了开发抗衰老干预措施的新靶标,可能有助于阻止年龄相关性疾病。相关研究结果近期发表在Cell期刊上,论文标题为“SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species”。论文通讯作者为罗切斯特大学生物学教授Vera Gorbunova和Andrei Seluanov。
SIRT6通常被称为“长寿基因(longevity gene)”,这是因为它在排列蛋白和招募修复DNA断裂的酶方面发挥着重要作用;另外,缺乏这个基因的小鼠过早衰老,而携带这个基因额外拷贝的小鼠则活得更长。这些研究人员猜测如果更有效的DNA修复是更长寿命所必需的,那么寿命更长的有机体可能进化出更有效的DNA修复调节因子。 SIRT6活性因此在长寿物种中增强了吗?
为了验证这个观点,这些研究人员分析了18种寿命从3年(小鼠)到32年(裸鼹鼠和海狸)的啮齿类动物物种的DNA修复。他们发现具有较长寿命的啮齿类动物也经历了更有效的DNA修复,这是因为它们的SIRT6基因的表达产物---SIRT6蛋白---更为强效。这也就是说,SIRT6在每个物种中都不相同。相反,这个基因与长寿共同进化,变得更有效,因此具有更强SIRT6活性的物种活得更长。Bohmann说,“SIRT6蛋白似乎是寿命的主要决定因素。我们证实如果在细胞水平上,这种DNA修复效果更好,那么在有机体水平上,就具有更长的寿命。”
这些研究人员随后分析了小鼠中发现的较弱的SIRT6蛋白与海狸中发现的较强的SIRT6之间的分子差异。Gorbunova说,他们鉴定出5个氨基酸负责让更强的SIRT6蛋白“在修复DNA方面更具活性,在酶功能方面表现更好”。当他们分别将海狸和小鼠SIRT6插入到人体细胞中时,海狸SIRT6要比小鼠SIRT6更好地减少应激诱导的DNA损伤。相比于携带着小鼠SIRT6的果蝇,海狸SIRT6也更好地延长了携带海狸SIRT6的果蝇的寿命。
1.Cell:我国科学家揭示人FcRn是B族肠道病毒的细胞脱衣壳受体
doi:10.1016/j.cell.2019.04.035
在一项新的研究中,中国科学院微生物研究所的高福(George F. Gao)课题组、北京大学的魏文胜(Wensheng Wei)课题组和首都医科大学附属北京儿童医院的谢正德(Zhengde Xie)课题组发现人新生儿Fc受体(human neonatal Fc receptor, FcRn)是主要的B族肠道病毒的脱衣壳受体。相关研究结果于2019年5月16日在线发表在Cell期刊上,论文标题为“Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.04.035。
这些研究人员发现FcRn通过它的FCGRT亚基与B族肠道病毒颗粒表面上的“峡谷”(Canyon)样结构部位结合。
通过在原子或近原子分辨率下在病毒进入宿主细胞的不同阶段获得多种低温电镜结构,这些研究人员破解了肠道病毒附着和脱衣壳的内在机制。这些结构揭示了与附着受体CD55不同的是,FcRn与B族肠道病毒颗粒颗粒的结合诱导了在酸性条件下“口袋因子(pocket factor)”的高效释放,并启动了病毒颗粒的构象变化,这为理解肠道病毒进入机制提供了结构基础。
2.Cell:我国科学家揭示基孔肯雅病毒入侵宿主细胞机制
doi:10.1016/j.cell.2019.04.008
在一项新的研究中,中国科学院北京生科院、微生物研究所高福(George F. Gao)课题组和中国科学院天津工业生物技术研究所、遗传与发育生物学研究所Feng Gao课题组解析出小鼠MXRA8、人MXRA8与基孔肯雅病毒E蛋白结合在一起时的晶体结构,以及人MXRA8和基孔肯雅病毒样颗粒的低温电镜结构。相关研究结果近期在线发表在Cell期刊上,论文标题为“Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein”。
这些研究人员发现蛋白受体MXRA8拥有两个具有独特拓扑结构的Ig样结构域。这种受体结合到基孔肯雅病毒颗粒表面三聚体刺突蛋白的两个E蛋白单体之间的“峡谷(canyon)”中。在基孔肯雅病毒E蛋白和MXRA8之间的结合界面的原子细节揭示出MXRA8的这两个Ig样结构域和连接这两个结构域的铰链区参与与来自基孔肯雅病毒的E1-E2蛋白氨基酸残基之间的相互作用。此外,MXRA8的茎部区(stalk region)对基孔肯雅病毒入侵宿主细胞至关重要。
这些发现为开发针对这些致关节炎甲病毒的治疗对策提供了重要信息。它们有助于筛选实验药物,评估实验性疫苗产生的抗体是否有可能预防感染,并分析病毒中的突变是否会影响它们的毒力。
3.Cell:挑战现有理论!揭示卵母细胞中促进细胞质与卵黄分离的机制
doi:10.1016/j.cell.2019.04.030
在早期鱼胚中卵黄与周围细胞质的分离是仔鱼(fish larva)发育的关键过程。在一项新的研究中,为了确定它的内在机制,来自奥地利科学技术研究所的研究人员发现细胞中的大量肌动蛋白动力学特性促进斑马鱼卵母细胞的相分离。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Bulk Actin Dynamics Drive Phase Segregation in Zebrafish Oocytes”。
在受精后不到两小时内,单细胞鱼卵就会演变成多细胞胚胎。在这两个小时内,后来形成动物体的细胞质必须与卵黄完全分离。以前,细胞生物学家已提出在卵的一极处的细胞表面局部扩张介导了这种分离。但是,缺乏支持这种模式的直接证据。
为了理解这种分离过程的物理基础,发育生物学家Carl-Philipp Heisenberg研究团队的Shayan Shamipour博士生与理论物理学家Edouard Hannezo的研究团队携手合作。基于这两个研究团队的综合专业知识,这些研究人员揭示出在细胞表面施加的力对于这一过程并不是必需的---这就与之前的模型相反。相反,他们发现在胚胎内部的拉力和推力共同作用下,卵黄颗粒(yolk granule)与细胞质更容易分离开来。重要的是,这种用于描述这一过程的理论可以应用于由于可动流体施加的力引起的任何分离,因此也可能用于探究哺乳动物/人类胚胎中的类似过程。
4.Cell:不育治疗新靶标!揭示EFCAB9引导精子进入卵子机制
doi:10.1016/j.cell.2019.03.047
当精子通过它们的尾巴上的一系列钙离子通道检测到环境变化时,它们就开始向卵子冲刺。在一项新的研究中,来自美国耶鲁大学等研究机构的研究人员鉴定出一种关键分子,它协调这些钙离子通道开启和关闭,从而激活精子并协助引导它们进入卵子。当通过基因编辑移除编码这种分子的基因时,雄性小鼠让更少的雌性小鼠怀孕,而且怀孕的雌性小鼠产生较少的幼仔。他们报道,这些经过基因编辑的雄性小鼠的精子活力较低,并且在实验室中让较少的卵子受精。相关研究结果近期在线发表在Cell期刊上,论文标题为“Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.047。
论文通讯作者、耶鲁大学医学院细胞与分子生理学助理教授Jean-Ju Chung说道,这种称为CatSper的钙离子通道复合物在精子尾部排列着。它在许多物种中在进化上是保守的,由多个亚基组成,但是“我们不知道每个亚基发挥的作用是什么”。
先前的研究未能确定CatSper的确切机制,该机制允许精子对女性生殖道的酸性水平等线索做出反应,并触发精子运动的变化,以便更好地导航到卵子。Chung实验室筛选了所有精子蛋白,以鉴定出哪些精子蛋白与钙离子通道复合物CatSper相互作用。他们专注于一种称为EFCAB9的精子蛋白,它作为一个传感器,根据环境线索协调这些钙离子通道的开启和关闭。
5.Cell:新的HIV疫苗递送策略可增强保护性的免疫反应
doi:10.1016/j.cell.2019.04.012
在一项新的研究中,来自美国斯克里普斯研究所、拉霍亚免疫学研究所和加州大学圣地亚哥分校等研究机构的研究人员报道一种新的HIV疫苗递送策略似乎在临床前模型中增强保护性的免疫反应。他们发现连续几天小剂量接种HIV疫苗要比一次性接种全部剂量的相同疫苗诱导更强的免疫反应。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Slow Delivery Immunization Enhances HIV Neutralizing Antibody and Germinal Center Responses via Modulation of Immunodominance”。
一种类似的逐步增加疫苗接种剂量的方法在未来的临床试验中可能是一种递送HIV疫苗的最佳方式。论文通讯作者、拉霍亚免疫学研究所疫苗发现部门Shane Crotty教授说道,“这篇论文展示了这种方法的力量。”
对这项新研究而言,Crotty和他的同事们比较了三种疫苗剂量策略,以便观察是否有更好的机会促使中和抗体产生。来自美国耶基斯国家灵长动物研究中心的研究合作者在恒河猴中测试了这些策略,其中恒河猴是一种研究人体免疫系统如何应对HIV的最佳动物模型。
这些研究人员测试了三种疫苗接种策略:一种传统的疫苗,其中这种疫苗是一次性注射;一种“渗透泵(osmotic pump)”策略,在这种策略中,植入物有点像定时释放的药丸缓慢地递送疫苗;一种逐步增加剂量的策略,在这种策略中,动物每隔一天给予部分剂量的疫苗,持续12天。
正如Crotty所说,传统的疫苗导致了一种可预测的“糟糕”的免疫反应,这种免疫反应以非中和性抗体为主。这项实验随后变得有趣。令所有人吃惊的是,后面两种缓慢释放的策略不仅导致更多的抗体,而且导致更好的抗体产生。
6.Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂
doi:10.1016/j.cell.2019.04.009
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员发现酿脓链球菌Cas9(SpCas9)的首批小分子抑制剂能够更精确地控制基于CRISPR-Cas9的基因组编辑。具体而言,他们通过开发一系列高通量生物化学分析方法和基于细胞的分析方法,筛选了许多小分子 ,以便鉴定出能够破坏SpCas9与DNA结合因而干扰它的DNA切割能力的化合物。这些首批小分子CRISPR-Cas9抑制剂很容易进入细胞,并且比之前发现的抗CRISPR蛋白小得多。这些新化合物可以对基于SpCas9的编辑技术进行可逆的和剂量依赖性的控制,包括它们在哺乳动物 细胞中进行基因编辑、碱基编辑和表观遗传编辑的应用。相关研究结果发表在2019年5月2日的Cell期刊上,论文标题为“A High-Throughput Platform to Identify Small-Molecule Inhibitors of CRISPR-Cas9”。

图片来自CC0 Public Domain。
论文通讯作者、布罗德研究所的Amit Choudhary说道,“这些技术为快速鉴定和使用针对SpCas9和下一代CRISPR相关核酸酶的小分子抑制剂奠定了基础。靶向CRISPR相关核酸酶的小分子抑制剂具有广泛应用于基础研究、生物医学和国防研究以及生物技术应用的潜力。”
7.Cell:我国科学家揭示环状RNA在先天免疫中起着重要作用
doi:10.1016/j.cell.2019.03.046
在真核生物中,共价闭合的环状RNA(circular RNA, circRNA)是由前体mRNA反向剪接数千个基因的外显子产生的。它们通常低水平表达,并经常表现出细胞类型特异性和组织特异性模式。鉴于circRNA的环状构象与线性mRNA对应物的序列重叠,对它们(特别是它们的功能)的研究充满挑战性。
在一项新的研究中,来自中国科学院和上海交通大学的研究人员发现大多数被研究的circRNA倾向于在分子内形成长16~26bp的不完美的RNA双链体(dsRNA)。此外,circRNA优先结合dsRNA激活的蛋白激酶(PKR),并且起着PKR抑制剂的作用。相关研究结果发表在2019年5月2日的Cell期刊上,论文标题为“Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity”。论文通讯作者为中国科学院生物化学与细胞生物学研究所的陈玲玲(Ling-Ling Chen)研究员、中科院-马普学会计算生物学伙伴研究所的杨力(Li Yang)研究员和上海交通大学医学院附属仁济医院的沈南(Nan Shen)研究员。
鉴于circRNA在正常条件下在被研究的细胞和组织中是稳定的,这些研究人员试图确定它们是否能够在某些类型的细胞应激下遭受降解。他们发现poly(I:C)和脑心肌炎病毒(EMCV)dsRNA都能够在病毒感染时通过激活的RNase L触发全局性的circRNA降解。
有趣的是,虽然circRNA和线性RNA都被RNase L降解,但陈玲玲课题组的早期研究已表明新生circRNA的产生很少见。因此,从前体mRNA产生的新生circRNA的数量并不能够克服早期先天免疫反应后RNase L在短时间内对它们的快速降解。这导致circRNA的全局性丧失和circRNA相关PKR的随后释放,因而允许PKR激活。
PKR由dsRNA直接激活,并在对dsRNA的细胞质反应中起重要作用。为了了解circRNA如何与PKR结合并调节它的激活,这些研究人员对通过引物延伸与突变分析测试方法分析的选择性2'-羟基酰化反应(selective 2'-hydroxyl acylation analyzed by primer extension and mutational profiling, SHAPE-MaP)进行了优化,发现大多数被研究的circRNA倾向于形成长16~26 bp的不完美的RNA双链体,所形成的RNA双链体在细胞中作为PKR抑制剂发挥作用。这表明RNase L对circRNA的大量和快速降解是PKR在先天免疫反应早期阶段的激活所必需的。
8.Cell:揭示肿瘤起始干细胞导致癌症在免疫治疗后复发
doi:10.1016/j.cell.2019.03.025
作为一种利用身体的免疫系统抵抗癌症的策略,免疫疗法极大地改善了患者的预后。但是,与许多其他的癌症治疗一样,免疫疗法的一个挥之不去的问题是癌症复发。在许多情况下,肿瘤复发了,但是医生并不知道其中的原因。
如今,在一项新的研究中,来自美国洛克菲勒大学等研究机构的研究人员鉴定出阻止免疫疗法的肿瘤细胞,并对它们如何做到这一点提出了新的见解。相关研究结果于2019年4月25日在线发表在Cell期刊上,论文标题为“Adaptive Immune Resistance Emerges from Tumor-Initiating Stem Cells”。论文通讯作者为洛克菲勒大学的Elaine Fuchs教授。
在这项新的研究中,论文第一作者、Fuchs实验室博士后研究员Yuxuan Miao及其同事们培育出患有一种鳞状细胞癌的小鼠,它们对免疫疗法反应良好。利用这种癌症小鼠模型,他们发现一部分称为肿瘤起始干细胞的癌细胞通过产生一种称为CD80的分子在这种治疗中存活下来,这种分子位于这些癌细胞的表面上并抑制体内旨在根除这种癌症的免疫细胞的有效性。
Fuchs团队还鉴定出一种首先触发这些肿瘤起始干细胞产生CD80的分子开关,即一种称为TGFβ的蛋白,这就为改进免疫疗法提供了潜在的新途径。比如,阻断TGFβ的抗体可能潜在地与常规的免疫疗法联合使用来克服这种抵抗性问题。
9.Cell:在世界海洋中发现将近20万种病毒群体
doi:10.1016/j.cell.2019.03.040
在一项新的研究中,来自美国、法国、瑞士、意大利、荷兰、加拿大、德国、英国、比利时和俄罗斯的研究人员报道世界海洋的病毒多样性比之前报道的要大得多。他们基于对146份海水样本的DNA分析,发现了将近20万种病毒群体。相关研究结果于2019年4月25日在线发表在Cell期刊上,论文标题为“Marine DNA Viral Macro- and Microdiversity from Pole to Pole”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.040。
这些研究人员在包括北冰洋和南冰洋在内的一系列探险中收集了来自将近80个地点的海水样本。他们指出,鉴于在将病毒定义为物种方面存在着争议,因此这项新的研究将病毒描述为群体。这些病毒群体可以分为五类:北冰洋、南冰洋、温带和热带海洋上层(temperate and tropical epipelagic, 水面以下200米)、海洋中层(mesopelagic, 水面以下200至1000米)和海洋深层(水面以下1000至4000米)。
科学家们对病毒在海洋生态系统中的作用很感兴趣。之前针对病毒的研究已报道海洋病毒在促进细菌和藻类死亡方面起着关键作用,这可能反过来影响海洋生产力。论文共同第一作者、美国俄亥俄州立大学的Ahmed Zayed表示,“病毒控制着微生物群落的结构,以及它们的进化轨迹。”
10.Cell:活性更强的长寿基因SIRT6意味着更长的寿命?
doi:10.1016/j.cell.2019.03.043
几个世纪以来,探险家们一直梦想着能有不老泉,它的泉水具有治疗作用,能使老年人恢复活力,并无限期地延长寿命。然而,在一项新的研究中,来自美国罗切斯特大学的研究人员发现了更多的证据表明长寿的关键在于一个称为SIRT6的基因。他们发现基因SIRT6在具有更长寿命的物种中负责更高效的DNA修复。这一发现揭示了开发抗衰老干预措施的新靶标,可能有助于阻止年龄相关性疾病。相关研究结果近期发表在Cell期刊上,论文标题为“SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species”。论文通讯作者为罗切斯特大学生物学教授Vera Gorbunova和Andrei Seluanov。
SIRT6通常被称为“长寿基因(longevity gene)”,这是因为它在排列蛋白和招募修复DNA断裂的酶方面发挥着重要作用;另外,缺乏这个基因的小鼠过早衰老,而携带这个基因额外拷贝的小鼠则活得更长。这些研究人员猜测如果更有效的DNA修复是更长寿命所必需的,那么寿命更长的有机体可能进化出更有效的DNA修复调节因子。 SIRT6活性因此在长寿物种中增强了吗?
为了验证这个观点,这些研究人员分析了18种寿命从3年(小鼠)到32年(裸鼹鼠和海狸)的啮齿类动物物种的DNA修复。他们发现具有较长寿命的啮齿类动物也经历了更有效的DNA修复,这是因为它们的SIRT6基因的表达产物---SIRT6蛋白---更为强效。这也就是说,SIRT6在每个物种中都不相同。相反,这个基因与长寿共同进化,变得更有效,因此具有更强SIRT6活性的物种活得更长。Bohmann说,“SIRT6蛋白似乎是寿命的主要决定因素。我们证实如果在细胞水平上,这种DNA修复效果更好,那么在有机体水平上,就具有更长的寿命。”
这些研究人员随后分析了小鼠中发现的较弱的SIRT6蛋白与海狸中发现的较强的SIRT6之间的分子差异。Gorbunova说,他们鉴定出5个氨基酸负责让更强的SIRT6蛋白“在修复DNA方面更具活性,在酶功能方面表现更好”。当他们分别将海狸和小鼠SIRT6插入到人体细胞中时,海狸SIRT6要比小鼠SIRT6更好地减少应激诱导的DNA损伤。相比于携带着小鼠SIRT6的果蝇,海狸SIRT6也更好地延长了携带海狸SIRT6的果蝇的寿命。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


