我国在2010~2019年制定的细胞治疗里程碑政策
来源:本站原创 2019-04-30 20:37
2019年4月30日讯/生物谷BIOON/---细胞疗法(即细胞治疗)是指将正常的或生物工程改造过的人体细胞移植或输入到患者体内,新输入的细胞可以替代受损细胞、或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。通常而言,细胞疗法主要包括肿瘤免疫疗法和干细胞疗法两大类。细胞疗法在治疗癌症、血液病、心血管病、糖尿病、老年痴呆症等方面前景广阔。来自健康供者免疫系统的人T细胞的扫描电镜图,图片来自NIA
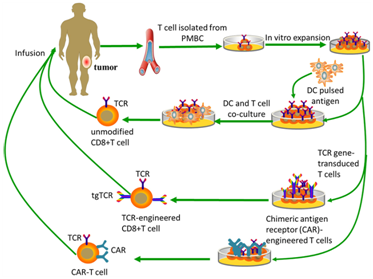
肿瘤免疫疗法是指获取来自患者体内的免疫细胞并对它们进行基因改造,然后让经过基因改造的免疫细胞进行体外培养和扩增,再回输到患者体内,来激发以及增强身体的自身免疫功能以治疗癌症等,主要包括过继细胞免疫疗法、肿瘤疫苗、非特异性免疫刺激和免疫检查点阻断疗法,其中过继细胞免疫疗法包括肿瘤浸润淋巴细胞(TIL)疗法、TCR-T细胞疗法、CAR-T细胞疗法、淋巴因子活化杀伤细胞(LAK)疗法、细胞因子诱导杀伤细胞(CIK)疗法、树突细胞疗法和自然杀伤细胞(NK)疗法。干细胞疗法是利用干细胞的自我更新能力和分化潜能,用于治疗血液系统疾病、神经系统疾病、心血管疾病、肝脏疾病和内分泌疾病等疾病。
因科学家们在免疫检查点抑制剂疗法和CAT-T细胞免疫疗法取得的重大进展,癌症免疫疗法被《Science》期刊评为2013年年度十大科学突破之首。CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy)细胞免疫疗法,即嵌合抗原受体T细胞免疫疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法,在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也有望用来治疗实体瘤、自身免疫疾病、HIV感染和移植排斥等疾病,具有更广阔的应用空间。
美国科学家詹姆斯•艾利森和日本科学家庶佑因在发现了抑制免疫负调节的癌症疗法——“免疫检查点疗法”---上作出的重大贡献而荣获2018年诺贝尔生理学或医学奖。这消息确实让人振奋,不仅仅是因为免疫疗法现在已经是国内外研究热点,更是因为它的出现将抗癌史推向一个新的里程碑。
干细胞(stem cell)是一类具有自我更新能力的多潜能细胞,即干细胞保持未定向分化状态和具有增殖能力,在合适的条件下给予合适的信号,它们可以分化成多种功能性的细胞,故而称其为“万用细胞”。干细胞来源于胚胎、胎儿组织和成年组织。根据发育阶段,干细胞分为胚胎干细胞和成体干细胞。根据干细胞的发育潜能,干细胞可分为三类:全能干细胞(totipotent stem cell,TSC)、多能干细胞(pluripotent stem cell)和单能干细胞(unipotent stem cell)(又称专能干细胞)。干细胞疗法属于新型生物医药技术,是一种先进疗法,也是再生医学的核心。1968年世界第一例骨髓移植术,开启了干细胞医疗技术的临床应用。经过半个世纪的发展,干细胞技术为人类疾病的治疗提供了独特的视角、方法和手段,为人类健康带来了新的希望和曙光。随着干细胞研究领域向深度和广度不断扩展,人们对干细胞的了解也将更加全面。
21世纪是生命科学的时代,也是为人类的健康长寿创造世界奇迹的时代,干细胞和免疫细胞的临床应用将有广阔前景。迄今为止,无论是利用自身细胞抗癌的“肿瘤细胞免疫治疗”还是万能的“干细胞治疗”,都拥有数千亿美金的市场空间,都代表着未来医学发展的重要方向。
细胞治疗技术已经成为近年来最引人注目的领域之一,虽然国内细胞治疗研究不断取得重要成果,但仍存在一些对细胞治疗技术的临床转化产生负面影响的不规范操作现象。我国对以免疫细胞治疗和干细胞治疗为代表的细胞治疗非常重视,先后出台多种策略来推动细胞治疗领域的研究开展和相关临床产业的健康有序发展,比如在上世纪 90 年代初就制定了《人的体细胞治疗及基因治疗临床研究质控要点》等一系列规范文件来促进干细胞和免疫细胞研究及临床产业的发展,2005 年底在《国家中长期科学和技术发展规划纲要<2005-2020>》中将基于干细胞的人体组织工程技术列入生物技术的前沿产业,并获得 973 计划、863 计划等国家重大科学研究计划的支持,干细胞基础研究、关键技术和资源都获得较大突破。
在此,着重关注一下过去十年(2010~2019)来,我国在细胞治疗领域制定的一系列重要的政策和法规。我国的细胞治疗政策总体上是大力支持,可分为三个阶段,如下所示:
1.上世纪90年代至2008年,政策开始大力支持细胞治疗研究,监管较为宽松
上世纪90年代,国内政策开始大力支持包括干细胞和免疫细胞在内的细胞治疗临床研究及应用,至2012年,监管一直处于较宽松状态,在此期间,我国进行了较多的干细胞治疗手术,当时脐带间充质干细胞治疗每年治疗例数为5000例左右,骨髓干细胞治疗每年治疗例数约为2000例左右,近300家医院和机构开展干细胞治疗。
这段时间的主要政策有:1993年的《人体细胞治疗及基因治疗临床研究质控要点》、1999年的《人体细胞治疗申报临床试验指导原则》,1995年的《脐带血造血干细胞库管理办法》(实行)、2001年的《脐带血造血干细胞治疗技术管理规范》(试行)、2002年的《脐带血造血干细胞库管理办法(试行)修正案、2003年的《人体细胞治疗研究和制剂质量控制技术指导原则》、2006年的《人体器官移植技术临床应用管理暂行规定》。
|
2002/10/8 |
脐带血造血干细胞库管理办法(试行)修正案 |
|
2003/3/20 |
人体细胞治疗研究和制剂质量控制技术指导原则 |
|
2006/3/27 |
人体器官移植技术临床应用管理暂行规定 |
|
2009/3/2 |
医疗技术临床应用管理办法 |
|
2009/5 |
自体免疫细胞(T细胞、NK细胞)治疗技术管理规范(征求意见稿),对开展自体免疫细胞临床应用作出了规定 |
|
2009/6/11 |
首批允许临床应用的第三类医疗技术目录 |
|
2009/7/7 |
细胞移植治疗技术管理规范(征求意见稿) |
|
2009/11/13 |
脐带血造血干细胞治疗技术管理规范(试行) |
|
2012.7 |
《“十二五”生物技术发展规划》,把干细胞与再生医学技术、基因治疗与细胞治疗技术列入发展重点 |
|
2011/12/26 |
关于开展干细胞临床研究和应用自查自纠工作的通知 |
|
2013/3/7 |
干细胞临床试验研究管理办法(试行)(征求意见稿) |
|
干细胞临床试验基地管理办法(试行)(征求意见稿) |
|
|
干细胞制剂质量控制及临床前研究指导原则(试行)(征求意见稿) |
|
|
2013/5/23 |
人胚胎干细胞研究伦理指导原则 |
|
2015/8/23 |
干细胞临床研究管理办法(试行) |
|
干细胞临床试验研究基地管理办法(试行) |
|
|
干细胞制剂质量控制及临床前研究指导原则(试行) |
|
|
2015/7 |
《国家卫生计生委关于取消第二类医疗技术临床应用准入审批有关工作的通知》,放开对肿瘤免疫技术审查 |
|
2015/12/1 |
关于开展干细胞临床研究机构备案工作的通知 |
由于细胞疗法具有特殊性,不同于常规药物,2009年卫生部将免疫细胞和干细胞治疗技术纳入可进入临床研究和应用的第三类医疗技术管理。随着干细胞行业快速发展,由于监管体制相对宽松,在未得到审批的情形下,各种形式的临床试验和临床应用项目迅速增加,在细胞治疗技术的临床转化领域也逐渐出现了一些负面的不规范应用,结果就是细胞治疗行业乱象横生。2009 年国家出台了多项重要法规,把包括干细胞和免疫细胞治疗在内的细胞治疗划为需要严格管制的“第三类治疗技术”,严令杜绝一切干细胞科研成果向临床转化的研究与应用,以此对细胞治疗的临床研究和应用规范进行整顿,细胞治疗发展速度有所减缓,但行业趋于规范,清理掉小、散、乱等现象。不过,与此同时,这也限制了我国细胞治疗产业的蓬勃发展。
2009年3月,原卫生部以规范性文件形式印发《医疗技术临床应用管理办法》,明确将医疗技术分为三类,对第三类医疗技术实施准入管理。这个《办法》中规定,“第三类医疗技术首次应用于临床前,必须经过卫生部组织的安全性论证和伦理审查,以及技术审核。”两个月后,原卫生部办公厅发布《首批允许临床应用的第三类医疗技术目录》,包括T细胞和NIK细胞在内的自体免疫细胞治疗技术位列其中。
2012年政府政策又进一步收紧,为促进干细胞治疗技术科学、有序地发展,规范干细胞临床研究和应用行为,整顿干细胞治疗工作,国家卫计委发布了《关于开展干细胞临床研究和应用自查自纠工作的通知》,叫停正在开展的未经批准的干细胞临床研究和应用项目。
3.2015~2019年包括干细胞和免疫细胞在内的细胞治疗发展总体上进入快车道,政策上大力促进
近年来,我国在包括干细胞和免疫细胞在内的细胞治疗方面的政策发布愈加频繁,这反映出国家层面对细胞治疗科技发展的推动和对整个细胞治疗行业的重视与关注。随着干细胞和免疫细胞的基础研究不断成熟,行业也逐步呼吁出台相关法规来规范和引导包括干细胞和免疫细胞在内的细胞治疗临床转化应用。单就干细胞领域,卫计委就在2015 年先后出台备受业界关注的干细胞三大政策《干细胞临床研究管理办法(试行)》《干细胞制剂质量控制及临床前研究指导原则(试行)》《关于开展干细胞临床研究机构备案工作的通知》文件,这是我国首个针对干细胞临床研究进行管理的规范性文件, 采取严格措施来规范干细胞研究和临床应用,未来干细胞临床应用和临床研究将有据可循,促进干细胞研究规范和快速发展。
(1)2016年细胞治疗领域总结:干细胞治疗技术大踏步向前发展,免疫细胞治疗技术因“魏则西”事件进入停滞期
2016年,干细胞和免疫细胞方面的研究受到全球及国内多重催化剂"共振",我国十分重视包括干细胞和免疫细胞在内的细胞治疗研究,出台了一系列政策为干细胞和免疫细胞研究和应用保驾护航。然而,与此同时,2016年4月发生的“魏则西”事件经过媒体宣传持续发酵,在社会上造成巨大影响, 免疫细胞治疗技术的滥用引起监管部门高度重视。卫计委召开关于规范医疗机构科室管理和医疗技术管理工作的电视电话会议,明确要求所有类型的免疫细胞治疗技术停止应用于临床治疗,仅限于临床研究。免疫细胞治疗在国内进入停滞期。
2016年1月5日,国家卫生计生委发布《关于延长脐带血造血干细胞库规划设置时间的通知》,决定将我委制定的脐带血造血干细胞库规划设置时间延长至2020年,即:2020年以前全国设置7家脐带血造血干细胞库,分别是北京市、天津市、上海市、浙江省、山东省、广东省、四川省脐带血造血干细胞库,不再新增。同时,积极筹建国家脐带血库。
2016年02月18日,我国卫计委发布“科技教育司2016年工作要点”, 提出加快重点研发计划项目组织实施强化干细胞临床研究管理等工作要点,开展日常监管,配合监督局组织开展专项整治,促进干细胞临床研究健康开展。
2016年03月22日,我药监局(CFDA)与卫计委共同成立国家干细胞临床研究管理工作领导小组,由卫计委副主任刘谦、CFDA副局长吴浈担任组长,旨在贯彻落实两大规范,促进干细胞临床研究工作有序进行。
2016年05月30日,在“科技三会”(全国科技创新大会、两院院士大会、中国科协第九次全国代表大会)上,国家主席习发表了以“为建设世界科技强国而奋斗”为主题的讲话。干细胞研究与纳米科技、肿瘤早期诊断标志物、人类基因组测序等基础科学突破,“两弹一星”等工程技术成果被列入讲话中,这些新科技的发展为我国成为一个有世界影响的大国奠定了重要基础。
2016年08月08日,国务院正式印发《“十三五”国家科技创新规划》(以下简称《规划》)。干细胞与再生医学作为新型生物医药技术,被强调要有创新突破和应用发展,以推动技术转化应用并服务于国家经济社会发展,大幅提高生物经济国际竞争力。
2016年10月10日,科技部官网发布了《关于发布国家重点研发计划干细胞及转化研究等重点专项2017年度项目申报指南的通知》,正式公布了14个重点专项2017年度项目申报指南。“干细胞及转化研究”试点专项继入列2016重点专项之后再次作为重点专项之一,被要求从包括干细胞临床研究、干细胞资源库等8个方面全面部署研究任务,力求推动干细胞研究成果向临床应用的转化,整体提升我国干细胞及转化医学领域技术水平。
2016年10月25日,中共中央、国务院印发的《“健康中国2030”规划纲要》全文公布。规划纲要提出,到2030年,我国主要健康指标进入高收入国家行列,人均预期寿命较目前再增加约3岁,达到79岁。其中,“干细胞与再生医学”作为重大科技项目被列入规划纲要,旨在推进医学科技进步,推动健康科技创新。 2016年10月25日,中国医药生物技术协会发布《干细胞制剂制备质量管理自律规范》,旨在规范我国干细胞制剂制备,加强质量管理,促进行业自律。中国医药生物技术协会自2015年4月组织业内骨干企业及专家参照《药品生产质量管理规范》(GMP)、《干细胞制剂质量控制及临床前研究指导原则(试行)》和《干细胞临床研究管理办法(试行)》等,经过一年多的研讨制订了这一规范。规范自发布之日(2016年10月25日)起施行。
2016年10月31日,国家卫生和计划生育委员会、国家食品药品监督管理总局按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,根据国家干细胞临床研究专家委员会对申报干细胞临床研究备案机构进行的材料审核结果,公布了首批干细胞临床研究机构名单。
2016年11月07日,国家卫生计生委和食品药品监管总局在北京召开了干细胞临床研究项目备案工作推进会。国家卫生计生委科教司、食品药品监管总局药化注册司、国家干细胞临床研究专家委员会秘书处有关负责人、6个省(市)卫生计生委科教处和食品药品监管局药化注册处相关负责人及9家已完成备案的干细胞临床研究机构代表参加了会议。
2016年11月24日,国家卫生计和食品药品监管总局在浙江杭州召开了省级医学伦理暨干细胞临床研究管理工作推进会,要求各省更好更快地推进干细胞临床研究。
2016年12月,《“十三五”国家占率性新兴产业发展规划》,对于生物医药健康领域,作出战略性挑战,并给出2016~2020年发展指示,其中基因编辑、液体活检以及细胞治疗等均榜上有名。同月,因受到魏则西事件的影响,《国家卫生计生委医政医管局关于召开规范医疗机构科室管理及医疗技术临床应用管理视频会议的通知》叫停细胞免疫治疗临床应用,规定其仅限于临床研究。与此同时,《细胞制品研究与评价技术指导原则(征求意见稿)》拟将细胞制品按药品评审原则进行处理。
(2)2017年细胞治疗领域总结:干细胞治疗和免疫细胞治疗技术爆发,临床应用研究政策支持力度强化
2017年是世界细胞治疗行业爆发的一年,更是中国细胞治疗产业爆发的一年。随着国家各部委发文支持,特别是“十三五”政策的下达,各省直辖市领会中央精神,纷纷发布政策,大力发展干细胞和免疫细胞产业,积极支持开展包括干细胞和免疫细胞在内的细胞治疗技术研究临床应用研究。
2017年1月12日,发改委发布《“十三五”生物产业发展规划》,指出要发展以干细胞和CAR-T细胞免疫疗法等生物治疗产品,以及建设个体化免疫细胞治疗技术应用示范中心,实现免疫细胞治疗关键技术突破,建设集细胞疗法新技术开发、细胞治疗生产工艺研发、病毒载体生产工艺研发,病毒载体 GMP 生产、细胞疗法 cGMP 生产、细胞库构建等转化应用衔接平台于一体的免疫细胞治疗技术开发与制备平台,为医疗机构提供高质量的细胞治疗产品,加快推进免疫细胞治疗技术在急性 B 细胞白血病和淋巴瘤等恶性肿瘤、以及鼻咽癌和肝癌等我国特有和多发疾病等领域的应用示范与推广,与此同时,推动个体化免疫细胞治疗的标准化和规范化,提高恶性肿瘤的存活率和生存期,满足临床需求、维护公众健康、降低医疗成本,使我国在免疫细胞治疗领域达到世界先进水平。
2017年2月,发改委又发布了《战略性新兴产业重点产品和服务指导目录》,支持针对恶性肿瘤等难治性疾病的细胞治疗产品等领域的生物产业发展。
2017年1月24日,科技部组织申报国家重点研发计划“干细胞及转化研究”。据通知表示,由中国生物技术发展中心承担管理的国家重点研发计划“干细胞及转化研究”、“数字诊疗装备研发”、“生物医用材料研发与组织器官修复替代”、“重大慢性非传染性疾病防控研究”和“生物安全关键技术研发” 5个重点专项2017年度项目已完成预评审,通过预评审的项目将进入正式申报书(含预算申报书)填报阶段。
2017年06月06日,国家科技部、国家卫生计生委、体育总局、食品药品监管总局、国家中医药管理局、中央军委后勤保障部等六部委联合印发《“十三五”卫生与健康科技创新专项规划》。规划中明确要求加强干细胞和再生医学、免疫治疗、基因治疗、细胞治疗等关键技术研究,加快生物治疗前沿技术的临床应用,创新治疗技术,提高临床救治水平。
|
时间 |
部门 |
政策名称 |
主要内容 |
|
2017年1月12日 |
发改委 |
“十三五”生物产业发展规划 |
培育符合国际规范的基因治疗、细胞治疗和免疫治疗等专业化服务平台,加快发展细胞治疗和免疫治疗等多个热门领域,从而推动个体化敏阿姨细胞治疗的标准化和规范化 |
|
2017年4月6日 |
卫计委 |
关于加强干细胞临床研究备案与监管工作的通知 |
认真组织开展第二批干细胞临床研究机构备案审核工作、督促已备案机构尽快进行干细胞临床研究项目备案、积极做好干细胞临床研究专项监督检查相关准备工作 |
|
2017年5月10日 |
科技部 |
“十三五”生物技术创新专项规划 |
重点加强干细胞的应用基础研究与转化研究,强化干细胞、生物医用材料与组织工程的交叉融合,引导我国生物医用材料产业的技术升级和细胞治疗等新治疗手段的规范化临床应用 |
|
2017年5月16日 |
科技部、卫计委、CFDA等 |
“十三五”卫生与健康科技创新专项规划 |
加强干细胞和再生医学、免疫治疗、基因治疗、细胞治疗等关键技术研究,加快生物治疗前沿技术的临床应用,创新治疗技术,提高临床救治水平 |
|
2017年5月24日 |
科技部 |
关于对国家重点研发技术干细胞及转化研究等重点专项2018申报建议征求意见 |
对国家重点研发计划干细胞及转化研究等6个重点专项2018年度项目申报指南向社会征求意见和建议。2018年,国家重点研发计划的6个重点专项之一是干细胞及转化研究。 |
|
2017年5月26日 |
科技部、发改委、卫计委等 |
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->

|

