多篇文章聚焦核小体研究新进展!
来源:本站原创 2020-09-26 12:05
核小体是由DNA和组蛋白形成的染色质基本结构单位,由DNA和H1、H2A、H2B、H3和H4等5种组蛋白构成,本文中,小编整理了多篇重要研究成果,共同解读近年来科学家们在核小体研究方面取得的新进展,分享给大家!图片来源:Science, 2020, doi:10.1126/science.abd0609【1】科学家们从不同角度揭示核小体结合抑制cGAS从而阻
核小体是由DNA和组蛋白形成的染色质基本结构单位,由DNA和H1、H2A、H2B、H3和H4等5种组蛋白构成,本文中,小编整理了多篇重要研究成果,共同解读近年来科学家们在核小体研究方面取得的新进展,分享给大家!
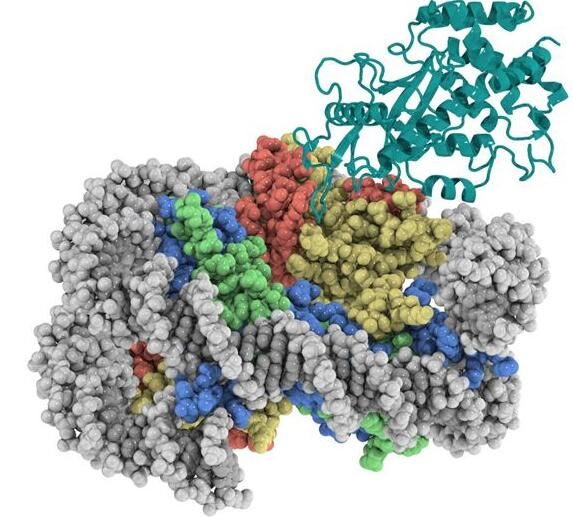
图片来源:Science, 2020, doi:10.1126/science.abd0609
【1】科学家们从不同角度揭示核小体结合抑制cGAS从而阻止自身免疫反应机制
doi:10.1038/s41586-020-2749-z等
高等生物细胞中的大部分DNA被限制在细胞核中,而所有其他细胞器DNA都被限制在细胞质中确定的细胞区室内。因此,DNA出现在细胞质的可溶性相(soluble phase)被先天免疫系统解释为细胞内病原体---通常是细菌或病毒---存在的信号,尽管肿瘤细胞和衰老细胞也可以将细胞核DNA或线粒体DNA释放到细胞质中。错位的DNA---无论是来自细胞核、线粒体还是细胞外的DNA---都会引起强烈的免疫反应,这种反应是由cGAS酶启动的。长期以来,科学家们一直认为cGAS本身只定位在细胞质中。
然而,近期的研究已表明,这种蛋白实际上优先存在于细胞核中。这一发现自然而然地提出了一个问题:是什么阻止了cGAS与细胞核DNA结合并引发自身免疫反应。在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA
【2】Nature:揭示核小体结合导致cGAS失活的分子基础
doi:10.1038/s41586-020-2749-z
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
doi:10.1038/s41586-020-2750-6
在一项新的研究中,来自瑞士洛桑联邦理工学院和巴塞尔大学的研究人员确定了人cGAS与核小体结合在一起时的分辨率为3.1埃的低温电镜(cryo-EM)结构。相关研究结果发表在Nature期刊上,cGAS与组蛋白H2A-H2B异源二聚体的酸性口袋(acidic patch)和核小体DNA广泛接触。结构和互补生化分析还发现cGAS与第二个核小体反式结合。从机制上看,核小体结合将cGAS锁定在单体状态,在这种状态下,空间位阻抑制了基因组DNA对cGAS的错误激活。
这些研究人员发现,cGAS-酸性口袋界面上发生的突变足以在体外消除核小体对cGAS的抑制作用以及在活细胞中触发cGAS在基因组DNA上的酶活性。这项研究揭示了cGAS与染色质相互作用的结构基础,并确定了一个令人信服的机制,从而允许cGAS对基因组DNA进行自我-非自我识别。
doi:10.1126/science.abd0237
在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上;这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。
【5】Science:从结构上揭示核小体依赖性的cGAS抑制机制
doi:10.1126/science.abd0609
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员首次确定了先天免疫系统中一种名为cGAS的关键DNA感应蛋白与核小体结合在一起时的高分辨率结构,其中核小体是细胞核内最重要的DNA包装单位。相关研究结果发表在Science期刊上。
这项研究详细揭示了我们细胞内的核小体如何阻止cGAS无意中触发人体对自身DNA的先天免疫反应,研究者表示,检测和响应来自细菌和病毒病原体的外来DNA是宿主防御的最基本机制之一。更深入地了解这种重要的DNA传感蛋白的功能和调节将对基础研究和对改善人类健康至关重要的cGAS靶向疗法的人体转化产生深远影响。

图片来源:Wikimedia Commons
doi:10.1038/s41586-019-1820-0
众所周知,包装DNA的组蛋白(H2A、H2B、H3和H4)需要分子伴侣。FACT(Facilitates Chromatin Transcription)蛋白是一类至关重要的组蛋白伴侣(histone chaperone)。将基因组DNA组装成核小体深刻地影响了真核生物中所有DNA相关过程。FACT蛋白由亚基SPT16和SSRP11组成,促进基因转录、DNA复制和DNA损伤修复过程中的核小体解构和重建。然而,迄今为止,FACT导致这些相反作用的机制是未知的。
在一项新的研究中,来自美国科罗拉多大学博尔德分校的研究人员报道了人FACT蛋白与部分组装的亚核小体(sub-nucleosome)结合在一起时的两种低温电镜结构图。他们发现FACT蛋白与核小体DNA和所有组蛋白发生广泛的相互作用,相关研究结果近期发表在Nature期刊上。
【7】PNAS:核小体或会抑制“基因魔剪”CRISPR-Cas9的切割效率
doi:10.1073/pnas.1810062115
近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自犹他大学的科学家们通过研究发现,核小体会抑制CRISPR/Cas9的切割效率,文章中,研究人员描述了如何在酵母样本中检测相关的基因编辑技术以及他们的研究发现。
“基因魔剪”CRISPR/Cas9能够利用导向RNA来寻找并且切割DNA片段,但当靶向片段是核小体的一部分会发生什么呢?此前研究人员通过研究发现,在这种情况下,似乎CRISPR/Cas9的切割效率会被降低;这项研究中,研究人员通过对这种情况进行体内试验发现,此前的研究结果是正确的,即利用CRISPR/Cas9切割核小体或许会降低其作用效率。
【8】Nature:新突破!揭示核小体的酸性口袋如何调节染色质重塑
doi:10.1038/nature23671
染色质是细胞核中的紧密缠绕的DNA-蛋白复合体。染色质重塑剂(chromatin remodeler)是被用来让染色质压缩和解压缩的蛋白,它们是至关重要的细胞过程(如DNA复制、重组、基因转录和抑制)的不可或缺的强大的调节物。在一项新的研究中,来自美国普林斯顿大学和洛克菲勒大学的研究人员揭示出关于一类被称作ISWI 的ATP依赖性染色质重塑剂如何调节对遗传信息的获取的更多细节,相关研究结果发表在Nature期刊上。
这些研究人员报道ISWI染色质重塑剂利用核小体的一种被称作“酸性口袋(acidic patch)”的结构特征,对染色质进行重塑。核小体是染色质的基础结构亚单位,经常被比作为缠绕在线轴上的线。这种酸性口袋是一种带负电荷的表面,位于核小体圆盘状机构(nucleosome disc)的每个面上。这种核小体圆盘状机构是由两个不同的组蛋白H2A和H2B提供的氨基酸形成的。组蛋白整体上带正电荷,这就使得核小体上的这种带负电荷的酸性口袋区域非常独特。人们之前从未发现对这种酸性口袋的识别会参与染色质重塑。
【9】Science:揭示核小体如何重定位有助认识遗传病产生
doi:10.1126/science.aak9867
在一项新的研究中,日本早稻田大学结构生物学教授Hitoshi Kurumizaka领导的一个研究小组解析出存在重叠的双核小体(overlapping dinucleosome,以下称重叠性双核小体)的晶体结构。核小体二联体是一种新发现的染色质结构单元。这可能解释了核小体重新定位如何发生,并且为开发治疗遗传疾病的药物提供有价值的信息。相关研究结果发表在Science期刊上。
人是由单个细胞发育而来的,这个细胞重复地发生分裂从而形成整个人。这些分裂的细胞都会携带相同的遗传信息,并且分化为具有不同功能的组织。比如,当手形成时,仅形成手的基因会“开启”,而除此之外的所有其他基因保持关闭。表观遗传学是一种旨在解释这种所谓的基因开关的研究领域,该基因开关控制着每个有机体染色质中的基因表达。
【10】Mol Cell:挑战常规!核小体也存在于活性增强子位点上
doi:10.1016/j.molcel.2016.03.001
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员对DNA上的调控序列的结构如何在细胞中组装提供新的认识。相关研究结果发表在Molecular Cell期刊上,这项研究对被称作增强子的基因序列在调控基因活性上所发挥的作用提供更好的理解。
增强子影响每个细胞中的基因“开启”或“关闭”,而且也控制着每个基因多大程度上被激活。这种控制水平最终决定着一种编码蛋白的表达水平作为对特定生理条件作出的反应。Zaret说,“最近的研究已证实增强子功能错误在包括多种类型癌症在内的众多疾病中发挥着至关重要的作用。基于此,我们需要详细地描述增强子如何工作。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


