中国科学家公布实验室mRNA新冠候选疫苗的动物数据
来源:生物谷 2020-05-19 11:01
新冠疫情如今已经在全球大范围蔓延。截止到发稿日,世界卫生组织的公开数据表明新冠确诊病例已经达到452万多例,而死亡人数也超过了30万例。其中美国是最严重的国家,累计确诊病例148万多例,死亡人数接近9万人。来自世卫组织的科学家表示控制住当前的新冠疫情可能需要4-5年的时间,有效的疫苗研制和成功的封锁措施都会决定大流行持续的时间。 目前,世界上在研的
新冠疫情如今已经在全球大范围蔓延。截止到发稿日,世界卫生组织的公开数据表明新冠确诊病例已经达到452万多例,而死亡人数也超过了30万例。其中美国是最严重的国家,累计确诊病例148万多例,死亡人数接近9万人。来自世卫组织的科学家表示控制住当前的新冠疫情可能需要4-5年的时间,有效的疫苗研制和成功的封锁措施都会决定大流行持续的时间。
目前,世界上在研的新冠疫苗有:病毒载体疫苗、灭活疫苗、减毒疫苗、mRNA疫苗、DNA疫苗、亚单位疫苗等。其中,我国的腺病毒疫苗和灭活疫苗已经相继进入了临床阶段。各种疫苗平台具有各自鲜明的特点,其中最引人著名的是基于mRNA技术开发的新型疫苗,代表企业包括Moderna、BioNTech、CureVac、StemiRNA等。
Moderna的mRNA-1273完成I期临床后已经获得FDA批准进入第二阶段的研究,同时被FDA指定为“快速通道指定药物”。外界评论mRNA-1273可能有资格获得“加速批准和优先审核”。BioNTech的候选疫苗BNT162也已经在德国和美国开展了人体临床试验,制药巨头辉瑞的加入使得BNT162能够快速进入临床开发的不同阶段。同时国内著名药企复星医药与BioNTech迅速开展合作,利用复星医药在中国广泛的临床开发、监管合规及商业能力,计划联合开发并推动BNT162在中国的临床试验。此外,CureVac与StemiRNA等公司也在加速推进新冠疫苗管线的开发。
5月15日,上海交通大学蔡宇伽团队联合复旦大学应天雷、洪佳旭团队以及本导基因公司在预印本平台bioRxiv公布了一种新型冠状病毒候选疫苗ShaCoVacc(BD131)的动物数据。ShaCoVacc(BD131)是基于自主研发的mRNA递送核心平台技术Virus-like particle (VLP)开发的,这是一种产生病毒模拟颗粒(Virus Simulating Particles)的新型技术。
新型冠状病毒SARS-CoV-2内部装载有病毒核酸,外部装饰有病毒棘突蛋白spike,致病力强大,但康复者依然可以产生能够抑制新冠病毒的中和抗体。ShaCoVacc的设计思路是最大限度的模拟新冠病毒,以期像新冠病毒自身一样在体内激活免疫系统,同时又避免在中间过程产生任何感染性的病毒。ShaCoVacc(BD131)通过mRNA表达spike蛋白仿生病毒内部的核酸(因而也是一种mRNA疫苗),并在疫苗表面装饰具有3D结构的spike蛋白(具备灭活疫苗的特点),从而自内而外最大程度的模拟新冠病毒。此外,ShaCoVacc(BD131)的疫苗表面也同时装饰有具有泛细胞偏好性的VSV-G膜蛋白,从而促进疫苗被抗原呈递细胞吸收,提高免疫效果。ShaCoVacc(BD131)疫苗的内部平均携带4个拷贝的mRNA,其表面的spike蛋白高度糖基化,类似于新冠病毒的毒棘突蛋白。另外,该疫苗不会激活I型干扰素,从而避免产生过量的细胞因子。
中和抗体的产生是评价一款疫苗的核心指标。科研团队通过给小鼠一次性注射1.5 ug p24剂量的疫苗,在第二周就可以在小鼠中观察到产生高滴度的spike特异抗体。同时,研究团队对免疫小鼠的血清进行抗病毒中和效果测试,在两种不同的假病毒体系中均显示高效的中和作用(EC50均值=908)。
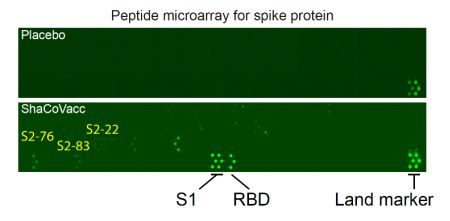
 为了研究ShaCoVacc(BD131)疫苗诱导产生的spike特异抗体的表位,研究团队通过多肽芯片技术全方位解析了抗体的表位。研究发现不同的小鼠接种ShaCoVacc(BD131)疫苗后,产生不同的抗体反应,其表位呈现多态性。同时,也发现了三个具有通用性的抗体表位,其中一个表位S2-83位于HR2。HR2区域在冠状病毒家族中具有很高的保守性(SARS-CoV与SARS-CoV-2一致),因此,研究团队认为ShaCoVacc(BD131)具备成为通用型疫苗的潜力。
为了研究ShaCoVacc(BD131)疫苗诱导产生的spike特异抗体的表位,研究团队通过多肽芯片技术全方位解析了抗体的表位。研究发现不同的小鼠接种ShaCoVacc(BD131)疫苗后,产生不同的抗体反应,其表位呈现多态性。同时,也发现了三个具有通用性的抗体表位,其中一个表位S2-83位于HR2。HR2区域在冠状病毒家族中具有很高的保守性(SARS-CoV与SARS-CoV-2一致),因此,研究团队认为ShaCoVacc(BD131)具备成为通用型疫苗的潜力。
“新冠疫情威胁着全球数十亿人的健康,我们团队与复旦大学应天雷及洪佳旭团队在疫情爆发后迅速开展合作,开发出ShaCoVacc(BD131)疫苗,并开展了疫苗的安全性、有效性的临床前研究”,上海交通大学系统生物医学研究院研究员,本导基因联合创始人兼首席科学家蔡宇伽教授说。“我们也在寻求与疫苗企业合作,进一步拓展ShaCoVacc(BD131)疫苗小规模生产及纯化工艺的优化,希望能快速推动进入临床试验。”
值得注意的是,由于该疫苗病毒的生产过程不会产生任何感染性的新冠病毒和病毒载体,因此不需要在严苛的P2和P3环境中完成生产。另外,由于mRNA以及spike蛋白存在时间短,通常在几天之内降解,使得该疫苗其相对于传统的减毒疫苗、DNA疫苗等具有更高的安全性。由于该疫苗平台由慢病毒载体技术发展而来,因而可以借助近些年来在细胞治疗中已经逐渐成熟的慢病毒工业化技术实现大规模生产。
目前,世界上在研的新冠疫苗有:病毒载体疫苗、灭活疫苗、减毒疫苗、mRNA疫苗、DNA疫苗、亚单位疫苗等。其中,我国的腺病毒疫苗和灭活疫苗已经相继进入了临床阶段。各种疫苗平台具有各自鲜明的特点,其中最引人著名的是基于mRNA技术开发的新型疫苗,代表企业包括Moderna、BioNTech、CureVac、StemiRNA等。
Moderna的mRNA-1273完成I期临床后已经获得FDA批准进入第二阶段的研究,同时被FDA指定为“快速通道指定药物”。外界评论mRNA-1273可能有资格获得“加速批准和优先审核”。BioNTech的候选疫苗BNT162也已经在德国和美国开展了人体临床试验,制药巨头辉瑞的加入使得BNT162能够快速进入临床开发的不同阶段。同时国内著名药企复星医药与BioNTech迅速开展合作,利用复星医药在中国广泛的临床开发、监管合规及商业能力,计划联合开发并推动BNT162在中国的临床试验。此外,CureVac与StemiRNA等公司也在加速推进新冠疫苗管线的开发。
5月15日,上海交通大学蔡宇伽团队联合复旦大学应天雷、洪佳旭团队以及本导基因公司在预印本平台bioRxiv公布了一种新型冠状病毒候选疫苗ShaCoVacc(BD131)的动物数据。ShaCoVacc(BD131)是基于自主研发的mRNA递送核心平台技术Virus-like particle (VLP)开发的,这是一种产生病毒模拟颗粒(Virus Simulating Particles)的新型技术。
新型冠状病毒SARS-CoV-2内部装载有病毒核酸,外部装饰有病毒棘突蛋白spike,致病力强大,但康复者依然可以产生能够抑制新冠病毒的中和抗体。ShaCoVacc的设计思路是最大限度的模拟新冠病毒,以期像新冠病毒自身一样在体内激活免疫系统,同时又避免在中间过程产生任何感染性的病毒。ShaCoVacc(BD131)通过mRNA表达spike蛋白仿生病毒内部的核酸(因而也是一种mRNA疫苗),并在疫苗表面装饰具有3D结构的spike蛋白(具备灭活疫苗的特点),从而自内而外最大程度的模拟新冠病毒。此外,ShaCoVacc(BD131)的疫苗表面也同时装饰有具有泛细胞偏好性的VSV-G膜蛋白,从而促进疫苗被抗原呈递细胞吸收,提高免疫效果。ShaCoVacc(BD131)疫苗的内部平均携带4个拷贝的mRNA,其表面的spike蛋白高度糖基化,类似于新冠病毒的毒棘突蛋白。另外,该疫苗不会激活I型干扰素,从而避免产生过量的细胞因子。
中和抗体的产生是评价一款疫苗的核心指标。科研团队通过给小鼠一次性注射1.5 ug p24剂量的疫苗,在第二周就可以在小鼠中观察到产生高滴度的spike特异抗体。同时,研究团队对免疫小鼠的血清进行抗病毒中和效果测试,在两种不同的假病毒体系中均显示高效的中和作用(EC50均值=908)。


“新冠疫情威胁着全球数十亿人的健康,我们团队与复旦大学应天雷及洪佳旭团队在疫情爆发后迅速开展合作,开发出ShaCoVacc(BD131)疫苗,并开展了疫苗的安全性、有效性的临床前研究”,上海交通大学系统生物医学研究院研究员,本导基因联合创始人兼首席科学家蔡宇伽教授说。“我们也在寻求与疫苗企业合作,进一步拓展ShaCoVacc(BD131)疫苗小规模生产及纯化工艺的优化,希望能快速推动进入临床试验。”
值得注意的是,由于该疫苗病毒的生产过程不会产生任何感染性的新冠病毒和病毒载体,因此不需要在严苛的P2和P3环境中完成生产。另外,由于mRNA以及spike蛋白存在时间短,通常在几天之内降解,使得该疫苗其相对于传统的减毒疫苗、DNA疫苗等具有更高的安全性。由于该疫苗平台由慢病毒载体技术发展而来,因而可以借助近些年来在细胞治疗中已经逐渐成熟的慢病毒工业化技术实现大规模生产。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->




