类风湿性关节炎(RA)新药!吉利德口服JAK1抑制剂filgotinib治疗52周显示持久疗效和一致安全性!
来源:本站原创 2020-06-07 14:04
filgotinib将成为吉利德推动未来增长的关键产品之一,2024年全球销售额预计将达到14亿美元。

2020年06月07日讯 /生物谷BIOON/ --吉利德科学(Gilead Sciences)与合作伙伴Galapagos NV近日公布了口服选择性JAK1抑制剂filgotinib治疗中度至重度类风湿性关节炎(RA)成人患者III期FINCH 1和FINCH 3研究的52周结果。数据显示,治疗52周期间,在RA患者群体中,filgotinib具有持续的疗效和一致的安全性。这些数据补充了大量的证据,支持filgotinib作为一种潜在的治疗选择用于一系列RA患者。
FINCH 1研究:在甲氨蝶呤(MTX)应答不足的RA患者中的52周数据:
FINCH 1研究在甲氨蝶呤应答不足(MTX-IR)的中度至重度活动性RA患者中开展,评估了filgotinib、安慰剂、阿达木单抗分别与稳定背景剂量甲氨蝶呤联合治疗的疗效和安全性。研究中,患者随机分组,接受每日一次200mg剂量filgotinib(n=475)、每日一次100mg剂量filgotinib(n=480)、每2周一次40mg剂量阿达木单抗(n=325)、安慰剂(n=475)。
如前所述,filgotinib 200mg组达到了主要终点:在第12周,与安慰剂组相比, filgotinib 200mg组有更高比例的患者达到ACR20应答。在与RA的症状体征、生理功能和结构损伤有关的所有次要终点方面,filgotinib均优于安慰剂。
FINCH 1研究中的大多数患者(80.7%,n=1417/1755)完成了研究药物52周治疗。在第52周,2种剂量filgotinib在主要和次要疗效评估中均显示出持续疗效。此外,与阿达木单抗组相比,在第52周,200mg filgotinib组有更高比例的患者实现低疾病活动度(DAS28(CRP)≤3.2)和临床缓解(DAS28(CRP)<2.6)(名义p<0.05)。基于CDAI≤2.8和Boolean缓解标准,在第52周,200mg filgotinib组缓解率也显著高于阿达木单抗组(名义p<0.05)。从基线检查到第52周,200mg filgotinib组与阿达木单抗组相比健康评估问卷-残疾指数量表(HAQDI)评分的下降幅度更大(名义p<0.05)。在这些终点,100mg filgotinib组与阿达木单抗组的应答率在数值上是相似的。
在这项MTX-IR患者的研究中,200mg和100mg filgotinib表现出一致的安全性,并且在52周期间没有检测到新的安全性信号。
FINCH 3研究:在没有接受过甲氨蝶呤(MTX初治)RA患者中的52周数据:
FINCH 3研究在甲氨蝶呤初治的中度至重度活动性RA患者中开展。研究中,患者随机分组,接受每日一次200mg剂量filgotinib+MTX(n=416)、每日一次100mg剂量filgotinib+MTX(n=207)、每日一次200mg剂量filgotinib单药治疗(n=210)、MTX单药治疗(n=416)。
如前所述, 200mg filgotinib+MTX组达到了主要终点:与MTX单药组相比,200mg filgotinib+MTX组有更高比例的患者达到ACR20缓解(p<0.001)。
FINCH 3研究中的大多数患者(80.7%,78.1%,n=975/1249)完成了研究药物52周治疗。在此次分析中,根据临床应答、身体功能和影像学进展,所有治疗组在治疗52周期间显示出持续的疗效。在治疗第52周,与MTX单药组相比,200mg filgotinib+MTX组、100mg filgotinib+MTX组、200mg filgotinib单药组有更高比例的患者达到ACR20应答(名义p<0.001,p<0.01,p<0.001)、ACR50应答(名义p<0.001,p<0.01,p<0.01)、ACR70应答(名义p<0.001,p<0.05,p<0.01)、疾病缓解(所有三组患者的名义p<0.001)。在第52周,与MTX单药组相比,200mg filgotinib+MTX组(名义p<0.001)或200mg filgotinib单药组(名义p<0.05)患者身体功能(通过HAQDI评分从基线水平的降低来衡量)显著改善。
在第52周,与MTX单药组相比,200mg filgotinib+MTX组(名义p<0.001)、100mg filgotinib+MTX组(名义p<0.05)、200mg filgotinib单药组(名义p<0.05)患者的结构损伤进展较小。
该研究中,filgotinib联合MTX或单药治疗在先前没有接受MTX(MTX初治)的RA成年患者显示出一致的安全性,没有发现新的安全信号。
FINCH 2研究:在生物类疾病修饰抗风湿药物应答不足(bDMARD-IR)的RA患者中的亚组分析数据:
尽管目前有可用的治疗方法,许多RA患者对bDMARD应答不足。在bDMARD-IR患者中,治疗第24周的亚组分析显示,与安慰剂相比,filgotinib显示出高比率的低疾病活动度和缓解,这与先前接受过的bDMARD数量、先前是否接受过IL-6或TNF抑制剂无关。与安慰剂组相比,200mg filgotinib组在低疾病活动度患者比例方面的差异具有统计学意义(p<0.001)。
各亚组的不良事件与整个研究人群一致。
III期FINCH和II期DARWIN项目的综合安全性分析:
对FINCH III期和DARWIN II期项目中7个临床试验中的filgotinib进行了综合安全性分析,数据强化了filgotinib治疗RA的一致安全性,未发现新的安全问题。在这些试验中,3827例RA患者接受了一剂以上的治疗,总暴露时间为4544.5患者年。
接受filgotinib治疗的患者中,导致死亡的严重不良事件(SAE)或治疗期间出现得不良事件(TRAE)暴露校正发生率(EAIR)与接受安慰剂、阿达木单抗、MTX治疗的患者中的EAIR具有可比性;未观察到剂量依赖性效应。
filgotinib严重感染和带状疱疹的EAIR与阿达木单抗、MTX相似。带状疱疹多为轻中度,不严重。与安慰剂相比,filgotinib在主要不良心血管事件(MACE)和静脉血栓栓塞(VTE)频率在数值上较低。此次综合分析中,filgotinib的耐受性良好,没有发现新的安全问题。
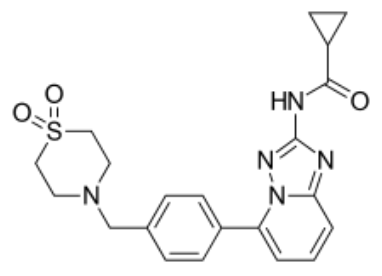
filgotinib分子结构式(图片来源:Wikipedia)
filgotinib是一种高度选择性JAK1抑制剂,由Galapagos发现和开发。吉利德于2015年12月底与Galapagos达成了总额高达20亿美元的协议,共同开发filgotinib。此次合作,将有助于增强吉利德在炎症性疾病领域的地位,该领域也将成为继丙肝和HIV领域之后吉利德在未来的新的增长点。
2019年12月,吉利德向美国FDA提交了filgotinib治疗类风湿性关节炎(RA)的新药申请。值得一提的是,吉利德还提交了一张优先审评券,来缩短审查时间。目前,filgotinib治疗RA适应症也正在接受欧盟和日本监管机构的审查。除了RA之外,双方也正在开发该药用于多种其他炎症性疾病,治疗克罗恩病、溃疡性结肠炎已进入III期研究。
医药市场调研机构EvaluatePharma此前预测,filgotinib将成为吉利德推动未来增长的关键产品之一,2024年全球销售额预计将达到14亿美元。不过,在JAK抑制剂领域,filgotinib也将面临多个竞争产品,除了2款已上市产品辉瑞Xeljanz和礼来Olumiant之外,更强劲的对手将是艾伯维的Rinvoq,该药已获美欧批准,治疗中度至重度RA。EvaluatePharma此前还预测,Rinvoq上市后在2024年的销售额将达到25.7亿美元。(生物谷Bioon.com)
原文出处:Filgotinib Demonstrates Durable Efficacy and Consistent Safety Profile at 52 Weeks in FINCH 1 and 3 Studies in Rheumatoid Arthritis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


