肺癌精准医疗!艾伯维抗体偶联药物Teliso-V获美国FDA突破性药物资格:治疗c-Met过表达肺癌疗效显著!
来源:本站原创 2022-01-12 01:01
在c-Met高表达、EGFR野生型、非鳞状NSCLC患者中,Teliso-V单药治疗的总缓解率(ORR)高达53.8%。
2022年01月11日讯 /生物谷BIOON/ --艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已授予telisotuzumab vedotin(Teliso-V)突破性疗法认定(BTD),用于治疗:接受含铂方案治疗期间或之后疾病进展、c-Met高水平过度表达、晚期/转移性表皮生长因子受体(EGFR)野生型(WT)、非鳞状非小细胞肺癌(NSCLC)患者。值得一提的是,这是艾伯维实体瘤在研疗法获得的首个BTD,其血液癌症产品组合已获得10个BTD。
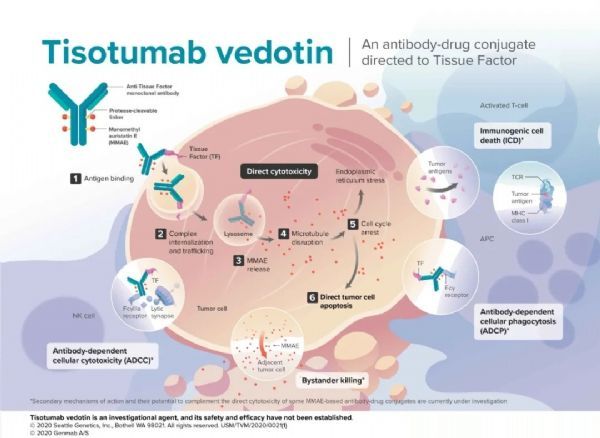
Teliso-V是一款靶向c-Met的抗体偶联药物(ADC)。c-Met是一种受体酪氨酸激酶,在包括NSCLC在内的多种类型肿瘤中过度表达。目前,尚无专门针对c-Met过表达NSCLC患者的抗癌药物。
BTD是FDA的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明与现有治疗药物相比在临床重要终点方面有显著改善的新药。
尽管在治疗方面已取得了进展,肺癌仍然是美国和全球男性和女性癌症相关死亡的首要原因。大约85%的肺癌被归类为非小细胞肺癌(NSCLC)。在标准护理治疗(包括含铂方案)后病情进展的患者,治疗选择有限,预后很差。
telisotuzumab vedotin(Teliso-V)作用机制(点击图片,查看大图)
FDA授予Teliso-V BTD,基于LUMINOSITY研究(Study M14-239)的数据支持。这是一项正在进行的2期研究,旨在确定在二线或三线治疗环境下最适合Teliso-V单药治疗的c-Met过度表达NSCLC目标人群,然后扩大组群以进一步评估Teliso-V在所选人群中的疗效。主要终点是:随访≥12周的癌症患者中,通过中心审查评估确定的总缓解率(ORR)。
先前报告的中期分析数据显示,在接受Teliso-V治疗的EGFR-WT非鳞状NSCLC患者中,c-Met高表达组的ORR为53.8%,c-Met中等表达组的ORR为25.0%。
目前,艾伯维正在开展1期M14-237研究,在先前接受过治疗的c-Met过表达NSCLC患者中,评估Teliso-V与osimertinib联合治疗。此外,该公司也正在随机3期TeliMET NSCLC-01研究(Study M18-868)中,进一步评估Teliso-V作为单药疗法,用于治疗先前接受过治疗的c-Met过表达NSCLC患者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->