多篇文章解读“铁死亡”研究领域新进展!
来源:本站原创 2020-07-23 20:36
本文中,小编整理了多篇重要研究成果,共同聚焦科学家们在“铁死亡”研究领域取得的新成果,分享给大家!图片来源:University of Michigan Rogel Cancer Center【1】Nature:鉴定出癌细胞逃避铁死亡新机制doi:10.1038/s41586-019-1707-0化疗通过阻止癌细胞增殖并诱导“细胞死亡”来杀死它们。细胞死亡的
本文中,小编整理了多篇重要研究成果,共同聚焦科学家们在“铁死亡”研究领域取得的新成果,分享给大家!
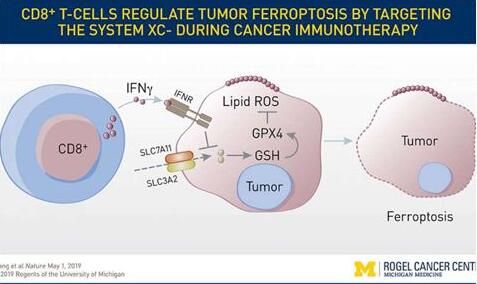
图片来源:University of Michigan Rogel Cancer Center
doi:10.1038/s41586-019-1707-0
化疗通过阻止癌细胞增殖并诱导“细胞死亡”来杀死它们。细胞死亡的一种形式称为铁死亡(ferroptosis)---铁依赖性细胞死亡---是由构成细胞膜的脂肪(脂质)降解引起的。很多侵袭性和抗药性的癌症易受铁死亡的影响,但是在一项新的研究中,来自德国维尔茨堡大学和亥姆霍兹慕尼黑中心等研究机构的研究人员发现了一种让癌细胞对铁死亡产生抵抗力的新机制。这就为开发抑制这种新发现机制从而允许铁死亡在易感的癌细胞中发生的药物提供了一种新的靶标。相关研究结果发表在Nature期刊上。
研究者表示,发现细胞获得抗药性的全新方式将使得我们能够设计靶向这种机制的药物。事实上,我们已经有了我们之前开发的间接地靶向这种机制的先导药物,并且正在实验室测试它们;铁死亡依赖于细胞膜上脂质的氧化---让这些脂质失去电子,从而导致它们降解。众所周知,一种称为谷胱甘肽过氧化物酶4(GPX4)的分子可以逆转这一过程,因而起着脂质抗氧化剂的作用,有一些靶向GPX4的药物,但是大多数癌症仍然对铁死亡有抵抗力。
【2】Nature:中美科学家揭示钙粘蛋白介导的细胞间相互作用调节癌细胞铁死亡机制
doi:10.1038/s41586-019-1426-6
铁死亡(ferroptosis)是一种由细胞代谢和铁依赖性脂质过氧化作用驱动的细胞死亡过程。它与缺血性器官损伤和癌症等疾病有关。谷胱甘肽过氧化物酶4(GPX4)是铁死亡的一种至关重要的调节剂,通过中和脂质过氧化物来保护细胞,其中脂质过氧化物是细胞代谢的副产物。直接抑制GPX4,或通过剔除它的底物谷胱甘肽或用于产生谷胱甘肽的前体分子(比如半胱氨酸)间接抑制GPX4,都可触发铁死亡。铁死亡有助于增强p53、BAP1和延胡索酸酶等几种肿瘤抑制蛋白的抗肿瘤功能。不过,违反直觉的是,易于发生转移并且经常对各种治疗产生抵抗性的间充质癌细胞(mesenchymal cancer cell)对于铁死亡高度敏感。
在一项新的研究中,中国空军军医大学的陈志南团队和美国纪念斯隆凯特琳癌症中心的Xuejun Jiang团队发现钙粘蛋白介导的细胞间相互作用能够非细胞自主性地调节铁死亡。相关研究结果发表在Natue期刊上;在上皮细胞中,由E-钙粘蛋白介导的这种相互作用通过激活细胞内NF2(也称为merlin)和Hippo信号通路来抑制铁死亡。抑制这种信号轴允许转录共激活因子YAP通过上调包括ACSL4和TFRC在内的几种铁死亡调节物来促进铁死亡。这一发现为具有间充质或转移特性的癌细胞对铁死亡高度敏感的观察结果提供了机制上的新见解。
【3】Nature:重大发现!靶向铁死亡有望增强免疫疗法的疗效
doi:10.1038/s41586-019-1170-y
在一项新的研究中,来自美国密歇根大学和Cayman Chemical公司的研究人员研究了一种鲜为人知的细胞死亡类型,即铁死亡(ferroptosis)。他们发现铁死亡在肿瘤细胞中发生,并且在癌症免疫中发挥作用。这些发现表明靶向这一途径有潜力让最热门的癌症治疗---免疫疗法---更加有效,相关研究结果发表在Nature期刊上。
研究者表示,铁死亡之前已被定义,但是人们并不知道它与癌细胞死亡或免疫细胞有关。这将为科学家们探索开辟了一个巨大的窗口。这些研究人员发现当免疫疗法增强T细胞的活性时,这会增加肿瘤细胞中的氧化脂质水平,从而导致铁死亡。基于对小鼠和人癌细胞的研究,增加的铁死亡会让免疫疗法更有效地杀死癌症。铁死亡是一种细胞死亡形式,不同于更为人熟知和充分研究的细胞凋亡。它依赖于铁,但对它的理解知之甚少。已知它参与大脑和肾损伤。这项研究是首次将它与免疫介导的癌细胞死亡相关联在一起。
【4】Cell Rep:防癌卫士p53也会帮助癌细胞 避免发生铁死亡
doi:10.1016/j.celrep.2017.12.077
癌细胞如何应答营养匮乏目前仍然不是特别清楚。在某些癌细胞内,半胱氨酸的缺乏会诱导铁依赖性细胞死亡,叫做铁死亡(ferroptosis),这种细胞死亡方式不同于细胞凋亡。最近的一些证据表明铁死亡的敏感性可能受到应激应答转录因子和经典肿瘤抑制因子p53的调节。
为了进一步揭示肿瘤抑制因子p53与铁死亡敏感性的关系,来自美国斯坦福大学医学院的研究人员利用CRISPR/Cas9基因组编辑、小分子探针以及高分辨率延时成像等技术进行了相关研究。研究结果发表在国际学术期刊Cell Reports上。在这项研究中,研究人员发现野生型p53的稳定表达会延缓半胱氨酸缺乏诱导的铁死亡,并且这种延缓作用需要p53转录靶基因CDKN1A(编码p21)的参与,除此之外还与细胞内谷胱甘肽的缓慢消耗以及活性氧簇水平的下降有关。
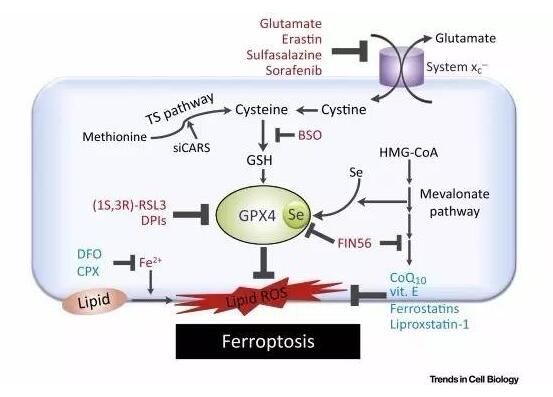
图片来源:Trends in Cell Biology
【5】Hepatology:中国科学家揭示铁死亡的肝损伤新机制
doi:10.1002/hep.29117
铁死亡(Ferroptosis): 近年发现的一种调节性坏死形式,是依赖于铁离子氧化损伤引起的细胞死亡模式,与凋亡、坏死或自噬有不同的特征。该死亡过程标志为细胞质和脂质活性氧增多、线粒体变小以及线粒体膜密度较大等。这种死亡方式被认为是一种治疗肿瘤以及众多重大疾病的突破口。铁死亡具有铁依赖性,可被铁螯合剂所特异性逆转,但铁过载是否会导致铁死亡、以及铁死亡与铁代谢之间发生机制还不清楚,该成果成功的解读了这个谜团。
为了探讨铁离子在铁死亡发生中的作用,本研究引入了多个高铁蓄积的基因敲除小鼠模型,或称为血色病小鼠模型。遗传性血色病(Hemochromatosis)是常见的慢性铁负荷过多的常染色体遗传疾病。由于过多铁储存于肝脏、心脏和胰腺等实质性细胞,最终导致组织器官退行性变病变,是引发肝病、糖尿病、心脏病等慢病的重要病因。血色病在欧美白人中发病率极高(1/200),是排名第一的人类肝脏遗传病;该疾病在我国发病率也逐年上升。
【6】Nature子刊:能杀死癌细胞的“铁死亡”疗法是怎么一回事?
doi:10.1038/nchembio.2239
细胞有很多种死亡方式,包括凋亡、自噬和坏死。近年来,“铁死亡”(ferroptosis)作为一种新的细胞坏死方式逐渐进入了人们的眼帘。不同于通常的细胞坏死,铁死亡是一种受调控的坏死过程。铁死亡是由于膜脂修复酶——谷胱甘肽过氧化物酶(GPX4)失效,造成膜脂上活性氧自由基(ROS)的积累所致,而这一积累过程需要铁离子的参与。多种物质和外界条件可引发铁死亡。小分子erastin通过抑制质膜上的胱氨酸-谷氨酸交换体,降低了细胞对胱氨酸的获取,使得GPX4的底物——谷胱甘肽合成受阻,进而引发膜脂ROS的积累和铁死亡。此外,另一种小分子RSL3作为GPX4的抑制剂也可引发铁死亡。当GPX4基因被敲除后,小鼠会因出现肾衰竭而死亡。
铁死亡与肿瘤抑制、神经元退化、抗病毒免疫反应和缺血-再灌注损伤等多种生理和病理过程有关。站在药物研发的角度,我们可以促进铁死亡,以清除有害的癌细胞、病毒感染的细胞等;或者抑制铁死亡,以保护健康细胞。当然,这一切可能的治疗思路都需建立在对铁死亡机理的理解上。
doi:10.1038/nature14344
近日,细胞生物学领域著名华人科学家Wei Gu在国际期刊nature在线发表了他们的最新研究进展,他们发现经典肿瘤抑制因子p53能够通过调节细胞胱氨酸代谢以及ROS应答,介导ferroptosis过程,抑制肿瘤生长,拓展了人们对p53功能的新认识。
p53是一种肿瘤抑制基因(tumor suppressor gene),在所有恶性肿瘤中,50%以上会出现该基因的突变。p53介导的细胞周期暂停,细胞衰老和凋亡对于抑制肿瘤发展具有重要作用,同时有研究表明p53对细胞代谢活性的调节也是其发挥抗肿瘤作用的一项重要手段。
【8】Nat Cell Biol:铁死亡抑制剂开辟治疗新机会
doi:10.1038/ncb3064
科学家们已经发现,一种新形式的可以控制生物体组织中不成熟细胞死亡的机制,称为铁死亡(Ferroptosis),同时还发现了扭转死亡的机制。测试这个机制可以防止人肾细胞组织损伤,急性肾功能衰竭和肝损伤,帮助开发药理治疗这些疾病的可能性。到现在为止,铁死亡是细胞死亡的一种形式,仅在肿瘤细胞中被确定。但在Nature Cell Biology杂志上的研究证实,通过除去蛋白质Gpx4,Gpx4负责调节的细胞死亡过程也可在健康细胞中被触发。
为了解决这个问题,研究人员试图了解如何控制这个过程。通过使用脂质组学和广泛的分子筛选,团队发现了一个小抑制剂称为Liproxstatin-1,并证明其能够抑制铁死亡。然后科学家们使用该抑制剂,发现可以防止活生物体中细胞死亡。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


