银屑病新药!强生IL-12/23抑制剂Stelara(喜达诺)获美国FDA批准,治疗6-11岁儿科患者
来源:本站原创 2020-07-31 14:26
Stelara是唯一治疗中重度斑块型银屑病儿科患者(6-11岁)的IL-12/23抑制剂。

2020年07月31日讯 /生物谷BIOON/ --强生(JNJ)旗下杨森制药近日宣布,美国食品和药物管理局(FDA)已批准抗炎药Stelara(中文商品名:喜达诺,通用名:ustekinumab,乌司奴单抗注射液)扩大适应症,用于治疗中度至重度斑块型银屑病(PsO)儿科患者(6-11岁)。
在欧盟,Stelara于2020年1月获批用于中重度PsO儿科患者(6-11岁)。此前,Stelara被批准用于中重度PsO青少年(≥12岁)和成人患者。现在,Stelara是第一个也是唯一一个用于PsO儿科患者(6-11岁)的靶向IL-12/IL-23生物制剂,将为这些患者提供一种新的治疗选择。用药方面,Stelara通过皮下注射给药,在起始剂量后,每年给药4次。
斑块型银屑病(PsO)是成人和儿童中最常见的银屑病类型。该病是一种免疫介导的炎症性疾病,会影响皮肤,导致皮肤红肿或发炎,皮肤上覆盖着红色鳞状斑块。据估计,全球有多达1.25亿人、美国有超过800万人患有这种疾病,有近四分之一的PsO患者有中度至重度疾病。大约三分之一的银屑病患者在20岁之前出现首次症状,约2万10岁以下儿童诊断为银屑病。该病会对儿童的心理健康和总体生活质量产生深远的、长期的影响。儿童银屑病也与低自尊的高发生率相关,并且会对成年和以后产生长期的影响。
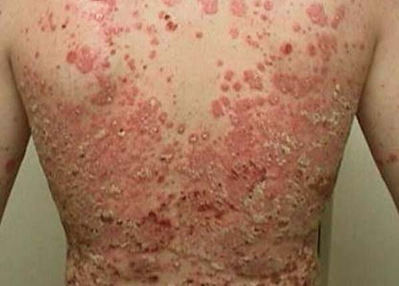
FDA批准Stelara用于儿科患者,基于III期CADMUS Junior研究的结果,该研究建立在先前III期CADMUS研究的基础上。研究发现:Stelara治疗显著改善了6-11岁儿科患者斑块型银屑病的症状和体征,同时改善了与健康相关的生活质量(HrQOL)。
CADMUS Junior是一项开放标签、单臂、多中心3期临床试验,研究对象为44例中重度斑块型银屑病儿科患者。结果显示,接受2剂治疗后,在第12周,有77%的患者皮损完全清除或几乎完全清除。次要终点包括:治疗第12周,银屑病面积和严重程度指数(PASI)评分与基线相比改善75%或90%的患者比例。结果显示:分别有84%和64%的患者实现PASI75缓解和PASI90缓解。总体而言,在CADMUS Junior试验中观察到的安全性与成人斑块性银屑病研究中的安全性相似。

Selara是全球首个可同时选择性靶向IL-12和IL-23的生物制剂。IL-12和IL-23是2种天然存在的细胞因子,被认为在免疫介导的炎症性疾病中发挥了关键作用,包括UC、斑块型银屑病、银屑病关节炎、克罗恩病等。Stelara通过与IL-12和IL-23共有的p40亚基结合,阻止其与细胞表面受体IL-12 β1结合,来抑制这2种前炎性细胞因子。
Stelara于2009年9月上市,目前已获批的适应症包括治疗:(1)中重度斑块型银屑病青少年(≥6岁)及成人患者;(2)活动性银屑病关节炎成人患者;(3)中重度克罗恩病(CD)成人患者;(4)中重度活动性溃疡性结肠炎(UC)成人患者。
在中国,Stelara(喜达诺®)于2019年6月上市,该药是一款具有创新给药模式——维持期每三个月皮下注射一次的生物制剂,用于治疗对环孢素、甲氨蝶呤(MTX)或PUVA(补骨脂素和紫外线A)等其他系统治疗不应答、有禁忌或无法耐受的成年中重度斑块状银屑病患者。
Stelara是强生进军自身免疫性疾病领域的一款核心产品,该药在2019年创下了63.61亿美元的销售额。今年1月,国际顶级期刊《自然》上发表的一篇文章(Top product forecasts for 2020)指出,随着适应症的不断增加、市场的不断扩大和渗透,Stelara在2020年的销售额预计将达到72.41亿美元,在《2020年全球最畅销TOP10药物》中排名第7位。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


