科学家们在人类肝癌研究领域取得的新进展!
来源:生物谷原创 2023-12-31 19:22
近年来,随着科学家们研究的不断深入,他们在人类肝癌研究领域取得了多项成果,本文中,小编就对相关重要研究领域进行整理,分享给大家!
近年来,随着科学家们研究的不断深入,他们在人类肝癌研究领域取得了多项成果,本文中,小编就对相关重要研究领域进行整理,分享给大家!
【1】Cell Death Dis:科学家有望开发出治疗人类肝癌的新型疗法
doi:10.1038/s41419-023-06302-0
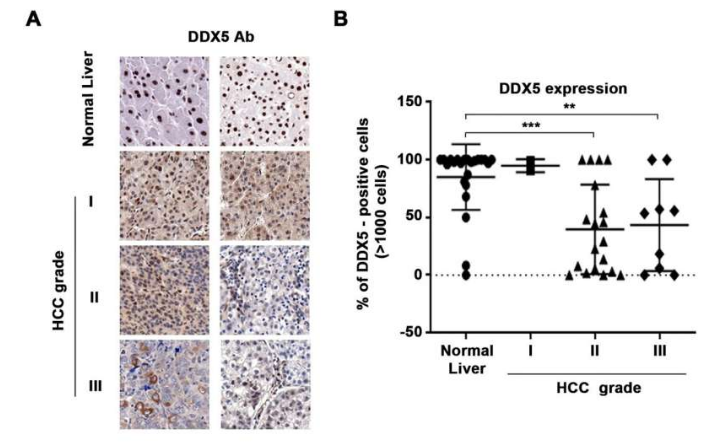
如今研究人员在理解天然存在的酶类与肝癌药物索拉非尼(sorafenib)之间的关系上取得了突破性的进展,这或许就有望改善药物的有效性,目前这种药物仅能将肝癌患者的寿命延长2-3个月,近日,一篇发表在国际杂志Cell Death & Disease上题为“RNA helicase DDX5 modulates sorafenib sensitivity in hepatocellular carcinoma via the Wnt/β-catenin–ferroptosis axis”的研究报告中,来自普渡大学等机构的科学家们通过研究揭示了酶类DDX5和肝癌药物索拉非尼之间的关联,或有望将现有的抗癌药物与刺激DDX5产生的疗法相结合从而作为一种有效的肝癌治疗手段。
科学家有望开发出治疗人类肝癌的新型疗法。
图片来源:Cell Death & Disease (2023). DOI:10.1038/s41419-023-06302-0
研究者Ourania Andrisani说道,如果我们能找到一种方法在治疗期间持续在肝脏中表达DDX5,那么索拉非尼和其它多酪氨酸激酶抑制剂或许就具有更好的抗肿瘤功效了,这或许是一项基础性的研究发现,由此我们就能想到开发有效治疗肝癌的新型疗法。每年全球有超过75万人死于肝癌,即使在富裕国家,肝癌患者的存活率也很低,从几个欧洲国家不到10%的比率到日本的30%不等。全球有超过一半的肝癌病例都是由乙型肝炎病毒所引起的慢性感染所引起的,如今研究人员正在揭示DDX5在病毒生物合成过程中所扮演的关键角色,DDX5是一类称之为RNA解旋酶的特殊蛋白质,其能修饰RNA的结构,并参与到了RNA生物学的所有方面。
在这项最新研究中,研究人员解决了DDX5和索拉非尼(一种公认能治疗肝癌的药物,但疗效短暂)之间的关联,在对接受索拉非尼治疗的患者的肝癌细胞和医疗记录的分析中,研究者发现,机体中DDX5水平较高的患者往往要比较低水平患者的寿命更长;有意识的是,索拉非尼自身能够降低肝癌细胞和肝癌动物模型机体中DDX5的水平,RNA测序结果表明该药物能激活Wnt/β-连环蛋白通路中必不可少的基因,而该通路是肝脏胚胎发育中正常激活的一系列分子步骤,当发生不合适的激活时往往就与肝癌发生直接相关。
【2】Cell:精氨酸或能驱动癌细胞的代谢重编程从而促进肝癌的进展
doi:10.1016/j.cell.2023.09.011
癌细胞是变色龙,其会完全改变代谢状况从而不断生长,近日,一篇发表在国际杂志Cell上题为“Arginine reprograms metabolism in liver cancer via RBM39”的研究报告中,来自瑞士巴塞尔大学等机构的科学家们通过研究发现,高水平的氨基酸—精氨酸或能驱动代谢重编程从而促进肿瘤生长,相关研究结果有望帮助开发改善人类肝癌治疗的新型疗法。肝脏是机体中具有多种重要功能的关键器官,其能代谢营养物质、储存能量并调节机体的血糖水平,在解毒和移除有害组分和药物上发挥着重要作用;肝癌是世界上最致死性的癌症类型之一,引发肝癌的因素包括肥胖、过度饮酒和丙肝感染等,早期的诊断和合适的治疗策略对于改善肝癌患者的治疗非常重要。
在过去10年里,科学家们在理解癌症的多面性上取得了重大进展,长期以来,人们一直将癌症视为细胞增殖紊乱,然而目前越来越多的研究证据表明,癌症实际上是一种代谢性疾病。换句话说,当细胞重新布局代谢并允许失控的细胞增殖时癌症就会发生,那么细胞是如何改变其代谢以及这种改变又是如何导致肿瘤发生的呢?这项研究中,研究人员在肝癌细胞中发现了驱动其代谢重新布局的一种关键驱动子。
健康的肝脏细胞在转变为癌细胞时会逐渐改变其行为,其会重新编程代谢来尽可能更快地生长,也会摄入比正常细胞需求更多的葡萄糖并增强对营养物质的摄取。研究者Dirk Mossmann博士说道,我们对来自小鼠和患者机体的肝脏肿瘤样本进行调查分析,结果发现了肿瘤样本中的精氨酸水平会升高,尽管癌细胞很少或基本不产生精氨酸,肿瘤细胞会通过增加对精氨酸的摄入并抑制其消耗从而积累高水平的精氨酸。
【3】CMGH:揭示肝脏细胞如何结疤并不断恶化直至进展到肝癌的?
doi:10.1016/j.jcmgh.2023.09.008
当疤痕组织取代了肝脏中受损的细胞时就会发生肝纤维化,随着时间推移,累积的疤痕组织就会扭曲肝脏,干预其血液供应并可能会逐渐进展为从肝硬化到肝衰竭再到肝癌的恶化结果,在晚期肝病病例中,患者的唯一治疗手段就是器官移植。近日,一篇发表在国际杂志Cellular and Molecular Gastroenterology and Hepatology上题为“The origin and fate of liver myofibroblasts”的研究报告中,来自加州大学圣地亚哥分校医学院等机构的科学家们通过研究描述了肝脏肌成纤维细胞(liver myofibroblasts)的来源和命运,其是一种形成肝脏疤痕组织的特殊细胞,而且最新研究证据表明,如果可能性的致病因子被移除的话,肝脏纤维化或许就会被逆转。
研究者Brenner博士说道,肝纤维化非常常见,部分原因是其或许会由多种损害器官功能的因素引起,但结果却是促使肝脏产生疤痕而并不是健康地修复,从病毒性肝炎到过度饮酒,再到非酒精性脂肪性肝病(NAFLD),这些在美国人群中非常常见。事实上,据估计,NAFLD在全球影响着大约10亿人的健康,这大约占到了全球人口的四分之一,大约20%的NAFLD患者都会进展为更严重的非酒精性脂肪性肝炎(NASH),其主要特征是肝脏的炎症、纤维化和肝硬化等。
这项研究中,研究人员解释道,肌成纤维细胞并不存在于正常健康的肝脏中,但却会在慢性肝脏损伤(比如过量饮酒)的反应中会被激活;一种炎性反应会诱发肝脏星状细胞的激活(aHSC),这些细胞会从相对稀少、静止以及储存维生素A的细胞转变为能分泌疤痕形成蛋白的增殖性肌成纤维细胞。这些肌成纤维细胞开始会形成无功能的疤痕组织的铁丝网结构,随着时间的推移,其会增厚并合并、堵塞肝脏,并引起其它危及生命的疾病。
doi:10.1136/gutjnl-2022-327909
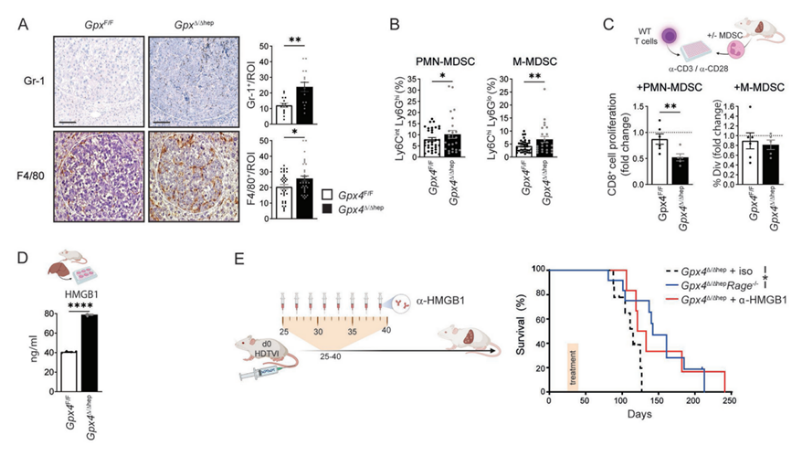
十年前,人们发现了一种新型的程序性细胞死亡:铁依赖性细胞死亡,即铁死亡(ferroptosis)。与一种长期以来众所周知的程序性细胞死亡类型---细胞凋亡---不同,在铁死亡中,细胞摄取了大量的铁。这些铁在细胞中发生代谢,并最终导致细胞膜的破坏。这种类型的细胞死亡是身体的重要控制机制之一,比如在发育过程和消除有缺陷或退化的细胞中。多年来,免疫疗法已经成为抗癌斗争中的一种治疗选择。在免疫疗法中,人体自身的防御系统被刺激,从而对抗癌细胞。其中的一些免疫疗法成功地靶向免疫系统中对该系统进行抑制的免疫检检查点。
免疫检查点是T细胞(抗癌免疫细胞)表面上的一种“关闭开关”,有了它,T细胞的活性就被下调。这种“关闭开关”是由某些“关键”蛋白操作的。许多肿瘤形成此类“关键”蛋白,以保护自己免受T细胞的攻击。这就是为什么通过阻断这种“关闭开关”发挥作用的称为免疫检查点抑制剂的药物如今是某些类型癌症的标准治疗的一部分。不幸的是,在其他类型的癌症(比如肝癌)中,对免疫检查点阻断的反应很低。近日,一篇发表在国际杂志Gut上题为“Combining ferroptosis induction with MDSC blockade renders primary tumours and metastases in liver sensitive to immune checkpoint blockade”的研究报告中,来自法兰克福大学医院等机构的研究人员在患有结直肠癌的小鼠身上观察到,一种引发铁死亡的物质会导致某些免疫细胞(T细胞)的激活。这些受到激活的T细胞可以系统地杀死癌细胞。
铁死亡诱导的T细胞活化和MDSC肿瘤浸润是肝细胞癌组合疗法的靶标。
图片来源:Gut, 2023, doi:10.1136/gutjnl-2022-327909。
问题是两种独立的机制立即使T细胞的活动再次停止:首先,癌细胞形成了一种“关键”蛋白来操作T细胞的“关闭开关”(免疫检查点受体PD-L1);其次,免疫系统的其他细胞,即所谓的髓样抑制细胞(MDSC)出现在现场,其任务同样是抑制身体的免疫反应。然而,当这些作者给患病的小鼠注射一种铁死亡激活剂、一种免疫检查点抑制剂和一种阻止骨髓抑制细胞招募的物质的三重组合时,这大大减少了肝肿瘤的生长。在对小鼠的进一步测试中,这些作者确定,这种三重组合疗法也能够减少源自转移性结直肠肿瘤的肝脏转移瘤数量。然而,结直肠瘤本身对这种三重组合疗法没有反应。
【5】Mol Cancer:我国科学家揭示赖氨酸羟化酶1促进肝癌细胞和胰腺癌细胞迁移和转移
doi:10.1186/s12943-023-01727-9
癌症转移是导致癌症相关死亡的一个主要原因。近日,一篇发表在国际杂志Molecular Cancer上题为“Lysyl hydroxylase LH1 promotes confined migration and metastasis of cancer cells by stabilizing Septin2 to enhance actin network”的研究报告中,来自中国香港城市大学等机构的科学家们通过研究发现了一种引发肝癌细胞和胰腺癌细胞迁移和转移并且与患者的生存时间缩短有关的蛋白。这些研究结果经体外和体内模型验证,并有临床数据支持,有望为癌症治疗提供一种新的潜在靶标。
研究者表示,癌症转移是一个复杂的过程。众所周知,肿瘤和周围组织的硬化程度随着肿瘤的生长而增加,这在多种癌症类型中为肿瘤细胞的迁移和转移创造了有限空间(confined space),即通道状的孔隙轨道。但这种在有限空间中迁移(下称受限迁移)的机制仍不清楚。我们的目标是深入研究癌症转移机制,并确定与之相关的新基因和蛋白。
作为最常见的肝癌类型,肝细胞癌(HCC)是世界上第二大癌症死因。胰腺导管腺癌(PDAC)是另一种高度侵袭性的癌症,五年生存率不到10%。这两种癌症都具有实体瘤的典型特征,即胞外基质(ECM)沉积过多,含有使癌细胞迁移的有限孔隙或通道状轨道。因此,这些作者选择了这两种不同的癌症类型作为研究对象。
这些作者首先收集了分别来自153名和63名患者的HCC和PDAC样本进行分析。这些作者在手术前没有接受化疗或放疗。他们还从美国国家卫生研究院获得了人类肝癌和胰腺癌细胞系。Yang教授解释说,“主要的挑战是模拟复杂的癌症微环境。但目前缺乏关于细胞在有限环境中迁移的研究模型。因此,我们开发了一系列多维平台以及二维和三维体外和体内模型,以全面研究细胞迁移过程。”
【6】Nat Cancer:科学家有望开发出一种治疗肝癌的新疗法
doi:10.1038/s43018-023-00523-0
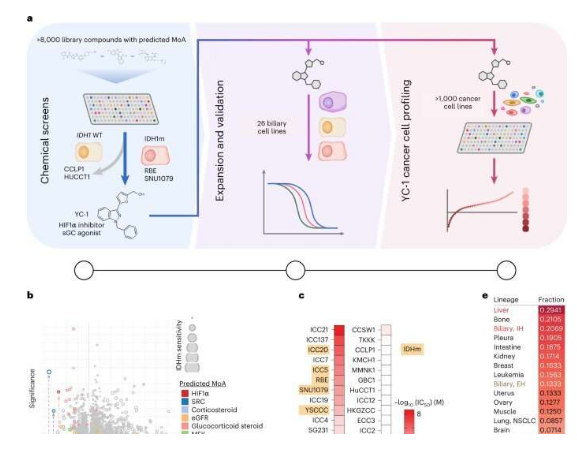
包括肝脏内胆管癌和肝细胞癌在内的成人肝脏恶性肿瘤是全球癌症相关死亡的第二大原因,大部分的患者都会接受化疗或免疫疗法,或者两种疗法的组合,同时也并没有特定的生物标志物可以选择。近日,一篇发表在国际杂志Nature Cancer上题为“SULT1A1-dependent sulfonation of alkylators is a lineage-dependent vulnerability of liver cancers”的研究报告中,来自美国国立卫生研究院等机构的科学家们通过研究解开了一种能抵御人类肝癌的潜在新型策略,其或有望帮助研究人员开发新型的抗癌药物;通过对细胞和小鼠进行一系列实验,研究人员发现,肝癌细胞中所产生的特殊酶类或能将一类化合物转化为抗癌药物,并能杀灭动物机体的癌细胞以及减轻疾病程度。
科学家有望开发出一种治疗肝癌的新疗法。
图片来源:Nature Cancer (2023). DOI:10.1038/s43018-023-00523-0
研究人员建议,这种酶类或能成为一种潜在的靶点来帮助开发抵御肝癌或其它类型癌症的新型药物。Matthew Hall博士说道,我们发现了一种特殊分子,其能以一种特殊的方式来杀灭罕见的肝癌细胞,这种分子是我们在筛选能选择性杀灭人类肝癌细胞的化合物分子中筛选出来的,我们花费了大量工作才发现它,而且其能在这些肝癌细胞中被一种酶类进行转化,并产生一种毒性的抗癌药物。
研究者Bardeesy最初对人类胆管癌进行研究,其是一类影响机体胆管的肝癌,主要特征表现为IDH1酶类的突变,于是研究者就想通过研究来发现特殊化合物和药物来有效抵御IDH1的突变,通过进行大量联合研究,研究人员就能快速检测数千种已经获批的药物和实验性抗癌制剂在以IDH1为靶点的情况下杀灭胆管癌细胞的作用效果。于是研究人员发现了多种分子(其中包括YC-1)能杀灭癌细胞,然而,当他们想观察YC-1是如何发挥作用时,他们发现这种化合物或许并不能影响IDH1的突变。
【7】J Hepatol:通常认为与晚期肝癌发生相关的介导子ATF4竟能保护肝脏免于肝癌的发生!
doi:10.1016/j.jhep.2023.03.016
肝癌是人类癌症死亡的第三大原因,也是全球第六大最常见的癌症类型,主要的风险因素包括环境和代谢压力,比如肥胖、病毒性肝炎和脂肪性肝炎(脂肪肝和炎症肝),这些压力会通过杀灭肝脏细胞(肝脏中的主要细胞类型)来损伤肝脏,随后细胞死亡就会诱发炎性反应,并向肝脏发送信号来产生一批新的肝脏细胞,但这种突然推动的细胞增殖也会增加肿瘤形成的风险。
近日,一篇发表在国际杂志Journal of Hepatology上题为“ATF4 suppresses hepatocarcinogenesis by inducing SLC7A11 (xCT) to block stress-related ferroptosis”的研究报告中,来自上海中医药大学等机构的科学家们通过研究调查了激活转录因子4(ATF4, activating transcription factor 4)的关键作用,ATF4是肝脏压力反应的一个关键介导子;尽管此前研究发现其与晚期肝癌发生有关,但研究人员发现,ATF4通常能保护肝脏免受肝脏细胞的死亡以及随后肿瘤的形成,这一出乎意料的结果有望启发科学家们开发新型临床策略来预防肝脏疾病和癌症的发生。
ATF4在健康细胞中的水平通常较低,但当细胞经历压力时其水平就会升高,为了研究ATF4在肝癌进展过程中所扮演的关键角色,研究人员开发了缺失ATF4的肝脏细胞的小鼠模型,随后研究者将小鼠暴露于多种压力下促使其肝脏损伤以及肿瘤的形成;研究人员非常惊讶地发现,缺乏ATF4的小鼠往往会表现出更多肝脏细胞的死亡、炎症、补偿性的细胞增殖以及加速肝癌的发生,这就表明,ATF4或许能以某种方式来保护机体抵御肝癌的发生。
【8】Cell Genom:科学家成功绘制出癌前肝脏细胞的基因特征 有望开发出预测肝癌风险的有效手段
doi:10.1016/j.xgen.2023.100301
当前对慢性肝脏疾病分期的方法对预测机体肝癌风险的作用往往有限;近日,一篇发表在国际杂志Cell Genomics上题为“Single Nucleus RNA Sequencing of Pre-Malignant Liver Reveals Disease-Associated Hepatocyte State with HCC Prognostic Potential”的研究报告中,来自科廷大学等机构的科学家们通过研究识别出了癌前恶性肝脏细胞的基因特征,这对于每年在澳大利亚被诊断出的近3000名致命性癌症的患者而言具有潜在的重要意义。
研究者表示,对肝脏疾病患者机体的癌变前细胞进行定量分析或许有助于确定个体未来患肝癌的风险,这一研究发现或许有望通过改变慢性肝病患者根据其癌症风险进行分期和监测的方式来挽救其生命。Rodrigo Carlessi博士指出,这项研究中,我们使用了最先进的技术来一次一个细胞地识别成千上万个基因的分子指纹,在这一过程中,我们发现了遗传特征及其诊断价值,随后还在数百个单独的患者肝脏样本中得到了证实。
这一研究发现意义重大,因为其给研究人员提供了一块重要的拼图,或许能为开发用于诊断肝癌的检测技术铺平道路;目前在澳大利亚,肝癌引发了所有癌症相关死亡病例中的10%的比例。澳大利亚人群通常发现肝癌时已经到了晚期阶段了,由于缺乏现成的和准确的实验室检测手段或生物标志物,很多晚期肝癌患者通常存活时间不超过12个月,因为患者发现肝癌时已经处于晚期阶段了,这时候患者的治疗方案往往非常有限。
doi:10.1097/CM9.0000000000002816
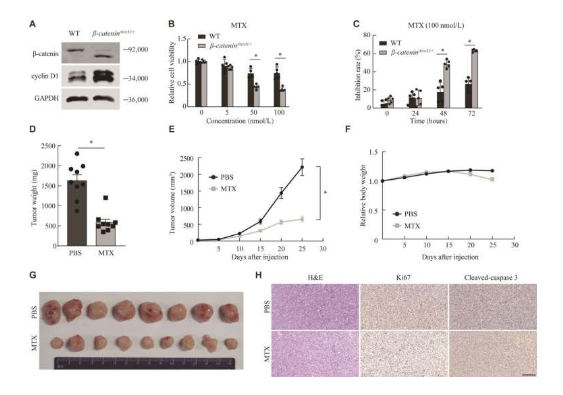
肝癌是全球最普遍且最致命的癌症之一,大多数患者确诊时已是晚期,因此患者可选择的治疗手段很少,不幸的是,用于治疗晚期肝细胞癌(HCC)的一线药物或许并不有效,临床治疗效益也并不高。在过去几年里,科学家们一直在尝试通过分析特定的遗传异常以及其影响疾病表现和进展的方式来开发治疗肝细胞癌的新方法,CTNNB1基因就是肝细胞癌中最常发生突变的基因,其编码着名为β-连环蛋白(β-catenin)的特殊蛋白质;这种蛋白质的突变版本能抵抗降解,从而就会促使其在受影响的细胞中不断积累,随着时间延续,过量的β-连环蛋白就会促使Wnt信号通路失调,从而引起失控的细胞增殖,然而,目前尚没有针对β-连环蛋白相关通路的疗法获批。
在此背景下,近日,一篇发表在国际杂志Chinese Medical Journal上题为“Oncogenic β-catenin-driven liver cancer is susceptible to methotrexate-mediated disruption of nucleotide synthesis”的研究报告中,来自中国科学院等机构的科学家们通过研究采用了一种不同的方法,他们开始研究确定是否当前的化疗药物能有效治疗β-连环蛋白激活的肝癌。老药新用时一种非常具有吸引力的策略,因为其能降低药物开发的总体成本并缩短开发的时间。
科学家有望利用甲氨蝶呤来治疗人类肝细胞癌。
图片来源:Chinese Medical Journal (2023). DOI:10.1097/CM9.0000000000002816
为了实现这一目标,研究人员首先利用12种广泛使用的化疗药物来进行筛选试验,通过利用培养的遗传修饰化细胞以及接种了能表达突变CTNNB1基因的皮下肿瘤的小鼠进行研究后,演技组合发现,药物甲氨蝶呤(MTX,methotrexate)或许能有效抵御β-连环蛋白激活的细胞,甲氨蝶呤是一种广泛用于治疗诸如银屑病、类风湿性关节炎和某些类型癌症的药物。随后研究人员还在体外和体内对β-连环蛋白所激活的人类肝癌细胞进一步研究验证了甲氨蝶呤的有效性和选择性。
【10】Adv Sci:科学家揭示由小细胞外囊泡所介导的特殊信号通路 有望帮助开发治疗人类肝细胞癌的新型疗法
doi:10.1002/advs.202302677
肝细胞癌是一种高血管性的恶性肿瘤,其生长和播散主要是由肿瘤衍生的小细胞外囊泡(sEVs,small extracellular vesicles)的调节来驱动的。近日,一篇发表在国际杂志Advanced Science上题为“Small Extracellular Vesicle‐Derived vWF Induces a Positive Feedback Loop between Tumor and Endothelial Cells to Promote Angiogenesis and Metastasis in Hepatocellular Carcinoma”的研究报告中,来自中国香港大学等机构的科学家们通过研究揭示了肝癌患者机体所衍生的循环小细胞外囊泡所介导的促进肝癌发生转移的未被识别的特殊信号通路,这一研究发现或有望帮助科学家们开发治疗人类肝癌的潜在治疗性策略。
在香港,肝癌是人群中第五大最常见的癌症类型和第三大癌症相关死亡的主要原因;作为一种高血管性的肿瘤,其常常是由肿瘤微环境中的小细胞外囊泡来调节驱动的。增强的血管化会促使肿瘤细胞进入到血液中,并能促使其播散到附近的位点进而实现癌症转移,如今越来越多的研究证据表明,肿瘤所衍生的小细胞外囊泡在调节血管生成信号的过程中发挥着重要作用,而理解肝癌中小细胞外囊泡调节血管生成背后的分子机制或有望帮助科学家们开发新型治疗性策略。
文章中,对受试者和肝细胞癌患者机体中循环的小细胞外囊泡进行蛋白质组学分析后,研究者发现,von Willibrand因子(vWF)或许会在肝癌的发生阶段逐渐上调;而且肝细胞癌患者机体中小细胞外囊泡-vWF水平的急剧上升或许表明其能作为一种肝癌的非侵入性诊断标志物;研究者还指出抗vWF抗体或能抑制晚期肝癌患者机体中循环的小细胞外囊泡在肝癌发生和转移过程中的诱导能力,这就阐明了小细胞外囊泡-vWF在肝癌中所扮演的关键角色。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


