2022年3月Science期刊不得不看的亮点研究
来源:本站原创 2022-03-31 17:24
2022年3月30日讯/生物谷BIOON/---2022年3月份即将结束了,3月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年3月30日讯/生物谷BIOON/---2022年3月份即将结束了,3月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:我国科学家领衔揭示关闭玉米和水稻中的KRN2/OsKRN2基因可提高作物产量
doi:10.1126/science.abg7985
在谷类植物进化的独立过程中,许多性状的转变似乎是在趋同选择下进行的,以满足人类的特殊需要。识别不同谷类植物的趋同选择的基因可能有助于阐明作物物种的进化并加速育种计划。在过去的几十年中,科学家们一直在争论不同作物品系中的趋同表型选择是由保守的分子变化还是由不同的分子途径驱动。作为两种最重要的经济作物,玉米和水稻在进化过程中显示出一些保守的表型变化---包括种子散播、种子休眠的减少和谷物数量的增加,尽管它们经历了独立的选择。因此,玉米和水稻可以作为一个很好的系统来了解谷类植物之间趋同选择的程度。
尽管发现了一些趋同选择的基因,但是人们对玉米和水稻之间在全基因组范围内的分子趋同程度的了解是非常有限的。为了了解选择作用于直系同源基因(orthologous gene)的频率,来自中国农业大学、中国科学院、华中农业大学、湖北洪山实验室、扬州大学和德国马克斯-普朗克分子植物生理学研究所的研究人员在一项新的研究中研究了玉米中的籽粒产量(grain yield)数量性状基因位点KRN2和其水稻直系同源基因OsKRN2的功能和分子进化。这些作者还利用两个大型数据集,在玉米和水稻的全基因组范围内确定了趋同选择的基因。相关研究结果发表在2022年3月25日的Science期刊上,论文标题为“Convergent selection of a WD40 protein that enhances grain yield in maize and rice”。
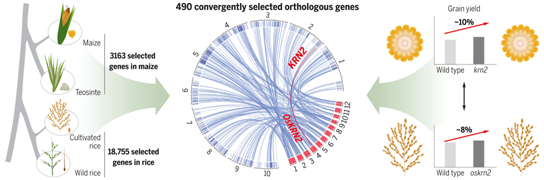
在玉米和水稻中共同选择的直系同源基因,用于在驯化和改良期间的趋同表型转变。图片来自Science, 2022, doi:10.1126/science.abg7985。
在全基因组范围内,这些作者确定了一组490个直系同源基因在玉米和水稻进化过程中经历趋同选择,包括KRN2/OsKRN2。他们发现,趋同选择的直系同源基因似乎在玉米和水稻的两个特定途径中明显富集:淀粉和蔗糖代谢,以及辅因子的生物合成。对淀粉代谢途径中趋同选择的基因的深入分析表明,通过趋同选择的遗传趋同程度与针对特定选择的基因网络的保守性和复杂性有关。
2.Science:重大进展!揭示哺乳动物大脑多巴胺释放新机制
doi:10.1126/science.abn0532
当我们在日常生活中发起一个行动---追赶失控的餐巾纸或下车---时,大脑会释放一种叫做多巴胺的化学信使,协助调节控制这一行动的大脑区域。多巴胺信号传递是一个高度复杂的过程,也是科学家们渴望了解的一个过程---特别是考虑到它在帕金森病等运动障碍中的作用。
如今,在一项新的研究中,来自美国哈佛医学院的研究人员确定了大脑释放多巴胺的一种新机制。他们发现另一种叫做乙酰胆碱的化学信使可以通过与多巴胺神经元的一个以前不知道会启动它们放电的部分结合来触发它们放电。相关研究结果发表在2022年3月25日的Science期刊上,论文标题为“An action potential initiation mechanism in distal axons for the control of dopamine release”。

图片来自Pixabay/CC0 Public Domain。
3.Science:重磅!揭示铜诱导的细胞死亡机制
doi:10.1126/science.abf0529
从细菌、真菌到植物和动物,铜都是生命的一个重要元素。在人类中,它与酶结合以协助于血液凝固、激素成熟和细胞处理能量。但是过多的铜会杀死细胞,如今科学家们找到了其中的原因。
在一项新的研究中,来自美国布罗德研究所的研究人员发现一种由铜诱导的新形式的细胞死亡。在布罗德研究所研究员Peter Tsvetkov和布罗德研究所主任Todd Golub的领导下,这些作者发现铜与专门的蛋白结合,导致它们形成有害的团块,并且还干扰了其他必需蛋白的功能,这会使得细胞进入毒性应激状态并最终死亡。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”。
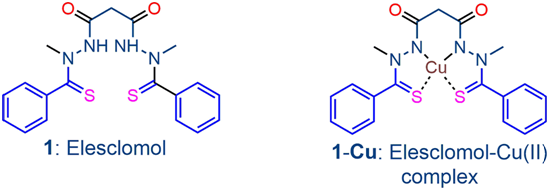
图片来自Front. Pharmacol., 29 September 2020, doi:10.3389/fphar.2020.558894。
4.Science:组蛋白H3.1在DNA复制期间调节Tonsoku介导的DNA修复
doi:10.1126/science.abm5320
组蛋白(histone)是一种高度碱性的蛋白,在将DNA包装到染色体中起着关键作用。在一项新的研究中,来自美国耶鲁大学和加拿大渥太华大学的研究人员展示了组蛋白中最微小的生化变化如何对所有植物和动物中的DNA复制和修复至关重要。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“The histone H3.1 variant regulates TONSOKU-mediated DNA repair during replication”。
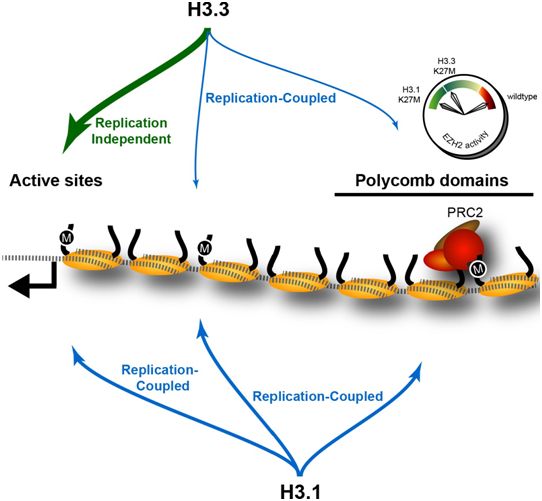
图片来自eLife, 2020, doi:10.7554/eLife.61090。
论文共同通讯作者、耶鲁大学分子、细胞与发育生物学助理教授Yannick Jacob及其团队利用开花植物拟南芥作为模型系统,揭示了对组蛋白H3.1关键作用的新见解。通过操纵这种植物的基因组,他们发现组蛋白H3.1的单一氨基酸变化在招募DNA复制过程中修复受损DNA所需的蛋白TONSOKU(TSK/TONSL)方面至关重要。
这些作者发现DNA修复蛋白TSK/TONSL通过组蛋白H3.1相互作用在DNA复制期间维持基因组稳定性。组蛋白H3.1的TPR(tetratricopeptide repeat)结构域对组蛋白H3.1的识别调节着这种DNA修复蛋白的活性。在从开花植物到哺乳动物中,组蛋白H3.1的这种作用可能是保守的。
5.Science:揭示细胞内钙离子释放在突触可塑性中起着关键作用
doi:10.1126/science.abm1670
在一项新的研究中,为了测试ICR是否参与经验依赖的可塑性,来自美国哥伦比亚大学的研究人员重点研究了海马体CA1区的锥体神经元(pyramidal neurons of hippocampal area CA1, CA1PN)。CA1PN接受来自多个传入回路的兴奋性输入,携带着关于动物环境的互补信息流,这些信息流冲击着CA1PN树突棘的不同区段。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Compartment-specific tuning of dendritic feature selectivity by intracellular Ca2+ release”。
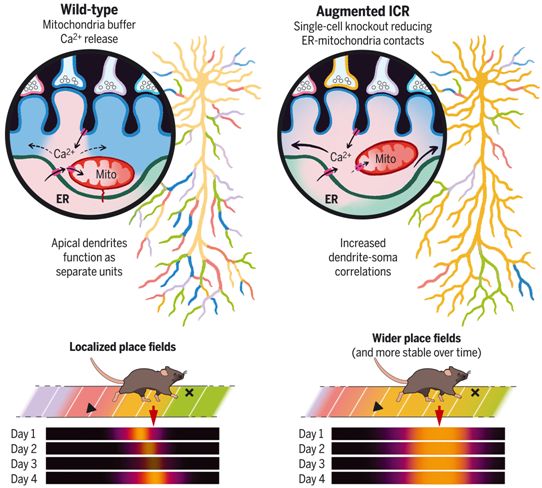
ICR塑造对空间导航很重要的接受域。图片来自Science, 2022, doi:10.1126/science.abm1670。
基于此,这些作者用CA1PN和BTSP作为模型系统来测试ICR是否参与了经验依赖的特征选择性的出现。他们实施了一系列基于单细胞电穿孔的工具,使得他们能够(i)利用条件基因缺失在单细胞分辨率下操纵ICR的细胞质影响,(ii)通过光遗传学手段诱导位置细胞,以及(iii)在空间导航期间同时对体细胞和树突的钙离子动态进行成像。
基因Pdzd8编码一种近期发现的内质网-线粒体连接蛋白,当被剔除时,会导致无限制的ICR。这些作者发现,在体内单个成年CA1PN中,Pdzd8的缺失大大增加了其顶端树突(apical dendrite)相对于CA1位置细胞胞体的空间共调谐水平,这一现象在基底树突(basal dendrite)中没有观察到,而在对照组CA1PN中,基底树突已与胞体高度共调谐了。最大化ICR导致更稳定地保留位置细胞的空间调谐,并改变其顶端树突的整合特性以形成输出水平的接受域。
6.Science:利用内源性标记构建出人类细胞蛋白分布图谱
doi:10.1126/science.abi6983
亚细胞定位和物理相互作用是与任何特定蛋白的功能紧密相关的关键方面。蛋白定位于不同的亚细胞区室,这使得细胞功能在空间上得到了分离。蛋白之间也有物理上的相互作用,形成将参与相同过程的蛋白连接起来的分子网络。因此,绘制细胞的分子分布图谱需要全面描述不同蛋白的定位位置以及它们如何相互作用。在其他策略中,绘制细胞结构的一种强有力的方法是利用与荧光蛋白“标签”的融合来可视化单个蛋白。这些标签不仅使我们能够对活细胞中的蛋白定位进行成像,而且还能通过作为免疫纯化-质谱分析(immunopurification–mass spectrometry, IP-MS)的手柄来测量蛋白相互作用。基因组工程的最新进展促进了对人类内源性基因的标记,从而使相应的蛋白可以在其天然的细胞环境中得到表征。
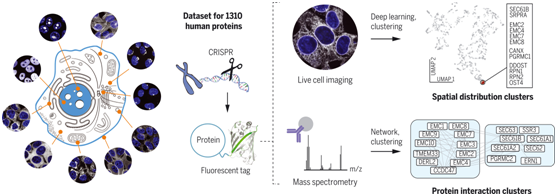
OpenCell:结合内源性标记、活细胞成像和相互作用蛋白质组学来绘制人类蛋白质组的分布。图片来自Science, 2022, doi:10.1126/science.abi6983。
应用无监督聚类(unsupervised clustering)和机器学习相结合的方法进行图像分析,使得这些作者能够客观地识别具有共同空间或相互作用特征的蛋白。他们的数据提供了对单个蛋白功能的新见解,但也使他们能够推导出人类细胞结构的一些一般原则。特别是,他们发现,结合RNA的蛋白形成了一个独立的由特定的定位和相互作用特征定义的亚组。他们还发现,一种给定蛋白的精确空间分布与它的细胞功能密切相关,这样就可以从成像数据的分析中获得精细的分子见解。他们的开源数据集可以通过opencell.czbiohub.org的交互式网络界面进行探索。
7.Science:最新发现!高血压药物或会影响机体大脑的功能!
doi:10.1126/science.abl5130
血管紧张素转化酶(ACE,Angiotensin-converting enzyme)能通过裂解血管紧张素I产生血管紧张素II来调节机体的血压,在大脑中,ACE在纹状体组织中尤为丰富,但ACE在纹状体回路中的功能,目前研究人员仍然知之甚少。近日,一篇发表在国际杂志Science上题为“Angiotensin-converting enzyme gates brain circuit–specific plasticity via an endogenous opioid”的研究报告中,来自明尼苏达大学医学院等机构的科学家们通过研究发现,血压药物或许对于机体大脑有着意想不到的影响效应。
研究者发现,用于治疗高血压的药物或能意外地增加大脑在自然状态下产生的阿片类物质的效果,这或许就能微调特定大脑回路的功能,并抵消诸如芬太尼等用于治疗疼痛的阿片类药物的成瘾性。研究者Patrick Rothwell说道,我们的研究结果揭示了一种新型策略,其或能以一种具有保护性和有益的方式来促进大脑中的阿片类信号通路,同时依赖性或成瘾性的风险较低。
研究人员重点分析了ACE,长期以来ACE被认为能调节机体的血压,然而,科学家们对其在大脑中的具体功能却知之甚少。基于本文研究结果,下一步研究人员将会继续研究ACE抑制剂,该抑制剂是一类用于控制机体血压的安全药物,其有可能会被潜在重新设计从而来帮助治疗大脑疾病。
8.Science:杏仁基底外侧核中的多巴胺分泌促进大脑进入快速眼动睡眠状态
doi:10.1126/science.abl6618
在一项新的研究中,来自日本筑波大学和中国北京大学生命科学学院的研究人员发现杏仁基底外侧核(basolateral amygdala)中多巴胺的产生与快速眼动(rapid eye movement, REM)睡眠的启动之间存在关联。相关研究结果发表在2022年3月4日的Science期刊上,论文标题为“Rapid eye movement sleep is initiated by basolateral amygdala dopamine signaling in mice”。
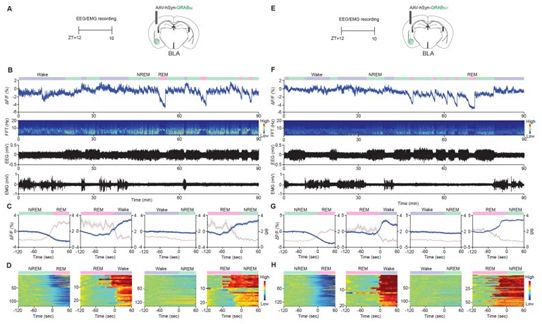
杏仁基底外侧核中的去甲肾上腺素和5-羟色胺水平在non-REM睡眠至REM睡眠切换前开始下降。图片来自Science, 2022, doi:10.1126/science.abl6618。
这些作者的研究工作涉及首先观察到杏仁基底外侧核中的细胞在睡眠周期的不同部分被激活。在此过程中,他们发现仅在大脑进入REM睡眠之前,大脑该区域中的多巴胺分泌增加。类似的变化在non-REM睡眠期间并没有发生。这就表明,多巴胺水平的增加与推动大脑进入REM睡眠状态有关。为了测试这一点,他们在小鼠处于non-REM睡眠状态时,人为地刺激大脑杏仁基底外侧核中的多巴胺产生,并发现这样做可推动大脑进入REM睡眠状态。
9.Science:揭示从头构建基因组的设计原则
doi:10.1126/science.abg0162
著名物理学家Richard Feynman有一句名言:“我不能创造的东西,我就不了解。”这句话不仅为Feynman的理论物理学方法提供了参考,也很好地描述了合成生物学家的动机,因为后者有兴趣从头开始构建基因组。通过设计和构建合成基因组,他们希望能更好地理解生命的密码。合成生物学一直是围绕着将DNA序列作为具有可复制功能的“部件(parts)”这一概念来组装的。如今,在一项新的研究中,通过成功的合作和对前沿工具的使用,欧洲分子生物学实验室(EMBL)的Lars M. Steinmetz团队对基因表达的变化有了重要的认识,这种变化是由这些DNA部件在基因组中的位置或背景造成的。相关研究结果发表在2022年3月4日的Science期刊上,论文标题为“Transcriptional neighborhoods regulate transcript isoform lengths and expression levels”。

通过低温电镜观察到两个转录因子(黄色和红色)与包裹在核小体中的DNA结合。图片来自Friedrich Miescher Institute for Biomedical Research。
这篇论文显示背景---特别是转录背景(transcriptional context)---改变了基因的RNA输出。通过使用长读直接RNA测序,他们能够观察到从合成酵母基因组中发生随机重排的DNA序列表达的全长RNA分子的起点、终点和数量的变化。基因的重新定位会影响其RNA输出的长度和丰度;然而,这些变化并不总是由新的相邻DNA序列来解释。似乎是发生在基因周围的转录,而不是它的序列本身,改变了它编码的RNA输出。
10.Science:构建出人类大脑血管的细胞图谱,确定一个新的免疫细胞群体与出血性中风相关联
doi:10.1126/science.abi7377
作为一种破坏性的中风形式,出血性中风占美国所有中风病例的10%至15%,主要是在年轻人中发生。大约一半的出血性中风是致命的。在一项新的研究中,来自美国加州大学旧金山分校的研究人员将形成人类大脑血管的所有细胞以及它们所在的位置和每个细胞中转录的基因编成目录。由此产生的大脑血管的细胞图谱描述了40多种以前未知的细胞类型,包括一个免疫细胞群体,这个免疫细胞群体与大脑血管细胞的沟通有助于出血性中风的发生。这些发现将成为全球范围内对大脑血管开展新研究的基础。相关研究结果于2022年1月27日在线发表在Science期刊上,论文标题为“A single-cell atlas of the normal and malformed human brain vasculature”。

小鼠全脑血管断层摄影图,图片来自Scientific Reports, 2018, doi:10.1038/s41598-018-30533-3。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


