抗移植新药!诺华JAK抑制剂Jakavi治疗类固醇难治性慢性移植物抗宿主病(GvHD)3期临床成功!
来源:本站原创 2020-12-07 14:55
Jakafi是一种口服JAK1/2抑制剂,已被批准治疗类固醇难治性慢性移植物抗宿主病。

2020年12月06日讯 /生物谷BIOON/ --诺华(Novartis)近日在第62届美国血液学会(ASH)年会上公布了关键III期REACH3研究(NCT03112603)的详细结果。这是一项随机、开放标签、多中心研究,在接受异基因干细胞移植后发生类固醇难治性或类固醇依赖性慢性移植物抗宿主病(GvHD)的儿童(≥12岁)和成人患者中开展。数据显示:与最佳可用疗法(BAT)相比,口服JAK1/2抑制剂Jakavi(ruxolitinib,鲁索替尼)显著改善了类固醇难治性/依赖性慢性GvHD患者的一系列疗效指标,包括无失败生存期(FFS)和患者报告的症状。
慢性GvHD是干细胞移植的一种危及生命的并发症,约半数患者会发展为类固醇难治性/依赖性。值得一提的是,Jakavi是在大规模随机临床试验中治疗类固醇难治性/依赖性慢性GvHD方面显示出疗效的第一个药物。根据REACH3研究结果,诺华计划在2021年上半年在欧洲的美国以外的国家提交Jakavi治疗类固醇难治性/依赖性GvHD患者的监管申请文件。
德国弗莱堡大学医院血液学、肿瘤学和干细胞移植科Robert Zeiser博士表示:“干细胞移植后慢性GvHD的破坏性和潜在致命性的影响给治疗带来了巨大的挑战,特别是对于近一半对类固醇治疗没有充分反应的患者来说。基于令人信服的REACH3研究的结果,我们现在针对这些患者将拥有一个潜在的新护理标准。”

在REACH3研究中,治疗第24周,研究达到了主要终点:与BAT组相比,Jakavi组总缓解率(ORR)显著提高(49.7% vs 25.6%,p<0.0001)。此外,Jakavi还显示在关键次要终点上有统计学意义和临床意义的改善:(1)与BAT组相比,Jakavi组无失败生存期(FFS;定义为疾病早期复发、启动新的系统疗法治疗慢性GvHD、死亡的死亡)表现出显著改善(中位FFS:未达到 vs 5.7个月;HR=0.370;95%CI:0.268-0.510;p<0.0001)。(2)根据改良LEE症状评分(mLSS)量表,采用总症状评分(TSS)相对基线降低≥7分的应答者比率来评价,Jakavi组患者报告的症状与BAT组相比有更大的改善(24.2% vs 11.0%;p=0.0011)。(3)Jakavi组有76.4%的患者实现最佳总缓解(BOR),BAT组为60.4%(OR=2.17;95%CI:1.34-3.52)。Jakavi组中位缓解持续时间(DOR)尚未达到,BAT组为6.24个月。
该研究中,没有观察到新的安全信号,治疗引起的不良事件(AE)与已知的Jakavi安全性相一致。Jakavi组和BAT组最常见的不良反应是贫血(29.1% vs 12.7%)、血小板减少症(21.2% vs 14.6%)、高血压(15.8% vs 12.7%)和发热(15.8% vs 9.5%)。尽管分别有37.6%和16.5%的患者需要Jakavi和BAT剂量调整,但因AE而中止治疗的患者数量较低(分别为16.4%和7%)。各治疗组的死亡率相似(19% vs 16%BAT)。Jakavi组主要由慢性GvHD引起的死亡人数略高。

移植物抗宿主病(GvHD)是异基因干细胞移植后常见且可能危及生命的一种并发症,这是供体细胞攻击受体正常细胞的一种反应,因为供体细胞将受体细胞视为外来细胞。2种主要的GvHD类型是急性GvHD(发生在移植后100天内)和慢性GvHD(发生在移植后100天内)。在异基因干细胞移植后,大约50%的患者会经历急性或慢性GvHD,或两者兼而有之。慢性GvHD的症状可影响皮肤、胃肠道、肝脏、口腔、肺和关节。对于初始类固醇治疗无应答或被认为是类固醇难治的患者,迫切需要额外的治疗选择。
REACH3研究的结果补充了先前报告的Jakavi治疗急性GvHD的关键III期REACH2研究的阳性结果,后者是治疗急性GvHD方面成功达到主要终点的第一个III期研究,数据显示:与最佳可用疗法(BAT)相比,Jakafi显著改善了类固醇难治性急性GvHD患者的一系列疗效指标。
在2019年5月,美国FDA根据单臂II期REACH1研究的结果,批准ruxolitinib(由Incyte公司在美国销售,商品名Jakafi),用于12岁及以上儿童及成人患者,治疗类固醇难治性急性移植物抗宿主病(GvHD)。值得一提的是,ruxolitinib是首个获FDA批准治疗类固醇难治性GvHD的药物。REACH1研究中,ruxolitinib治疗第28天的总缓解率(ORR)为57%、完全缓解率(CR)为31%。
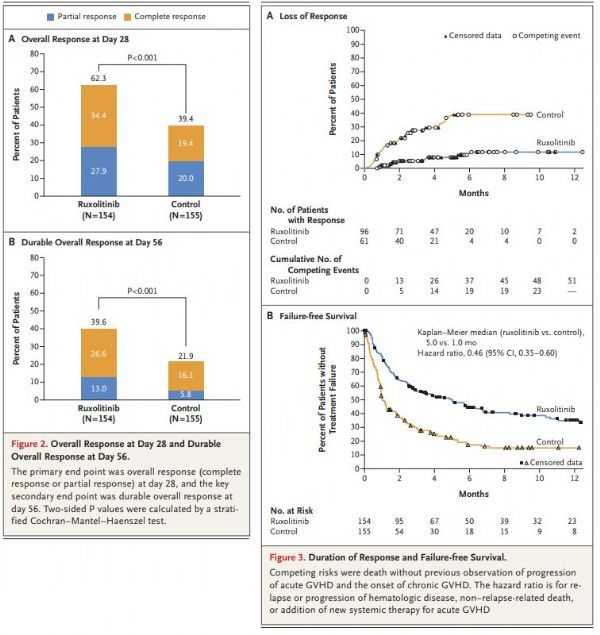
今年4月,REACH2研究结果发表于《新英格兰医学杂志》(NEJM):与BAT治疗组相比,Jakavi治疗组在第28天的总缓解率(ORR)显著提高(62% vs 39%,p<0.001),达到了研究的主要终点。关键次要终点方面,与BAT治疗组,Jakavi治疗组在8周内维持持久ORR的患者比例显著更高(40% vs 22%,p<0.001)。此外,Jakavi治疗组无失败生存期(FFS)较BAT治疗组延长(5.0个月 vs 1.0个月;HR=0.46,95%CI:0.35,0.60),其他次要终点也呈现积极趋势,包括缓解持续时间(DOR)。
ruxolitinib是一种首创的口服Janus激酶1和Janus激酶2(JAK1/JAK2)抑制剂。该药目前的适应症包括:骨纤维化、真性红细胞增多症(PV)、皮质类固醇难治性急性移植物抗宿主病(GvHD)。在美国市场,该药品牌名为Jakafi,由Incyte销售;在美国以外地区,该药品牌名为Jakavi,由诺华销售。
目前,Incyte公司也正在开发ruxolitinib乳膏剂,该制剂处于III期临床开发:(1)用于治疗轻度至中度特应性皮炎(TRuE-AD项目)患者,(2)用于治疗青少年和成人白癜风(TRuE-V项目)。Incyte拥有开发和商业化ruxolitinib乳膏剂的全球权利。之前公布的II期研究数据显示:与赋形剂对照(不含药物的乳膏)组相比,ruxolitinib乳膏剂治疗组患者面部白癜风严重程度指数评分显著改善、全身白癜风皮损复色(repigmentation)具有显著改善。今年2月,ruxolitinib乳膏剂治疗特应性皮炎III期项目获得了成功。(生物谷Bioon.com)
原文出处:Novartis announces first data from REACH3 trial showing Jakavi? (ruxolitinib) significantly improved outcomes in patients with steroid-resistant/dependent chronic GvHD
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->