超3000亿市场遭分食 31个生物类似药打头阵、排队上市
近期,国家药监局官网发布,我国第一个生物类似药——由复星医药子公司复宏汉霖研发的利妥昔单抗注射液(商品名:汉利康)获批上市,该药被批准用于非霍奇金淋巴瘤的治疗。这是继2015年2月8日,国家食品药品监督管理总局(CFDA)正式颁布《生物类似药研发与评价技术指导原则》(试行)以来,国内生物类似药研发史上又一里程碑事件。国内的自产生物类似药市场也从此开始萌芽。放眼全球,生物类似药已逐渐得到了更多认可,
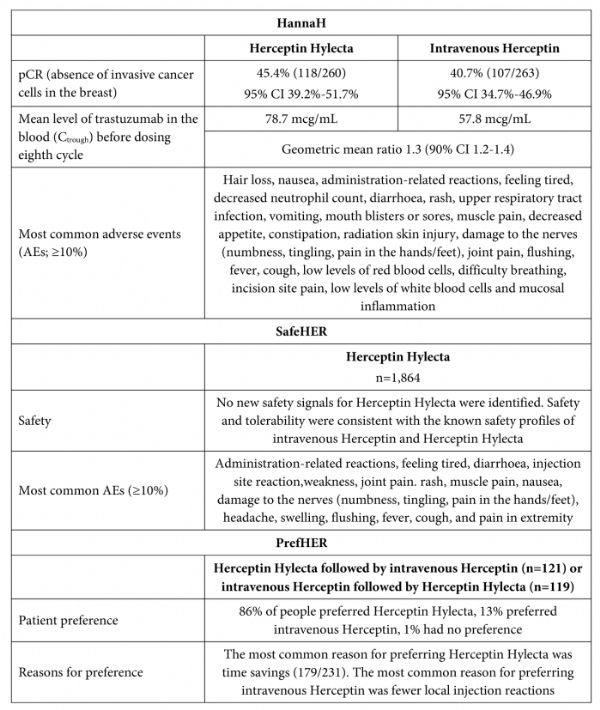
给药只需2-5分钟!罗氏皮下注射剂型赫赛汀(Herceptin Hylecta)获美国FDA批准
2019年3月4日讯 /生物谷BIOON/ --瑞士制药巨头罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已批准Herceptin Hylecta(trastuzumab and hyaluronidase-oysk,曲妥珠单抗和透明质酸酶)皮下注射液,用于:(1)联合化疗用于治疗HER2阳性早期乳腺癌(淋巴结阳性,或淋巴结阳性且ER/PR阴性,或具有一个高危特征)患者;(2)单独或联
首个国产生物类似药利妥昔单抗获批上市
2月22日,国家药品监督管理局批准上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(商品名:汉利康)上市注册申请。该药是国内获批的首个生物类似药,主要用于非霍奇金淋巴瘤的治疗。生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。生物类似药上市有助于提高生物药的可及性和降低价格,可以更好地满足公众对生物治疗产品的需求。为促进我国生物制药产业的健康、有序发展,国家
首个国产生物类似药!上海复宏汉霖利妥昔单抗(汉利康)获批,治疗非霍奇金淋巴瘤
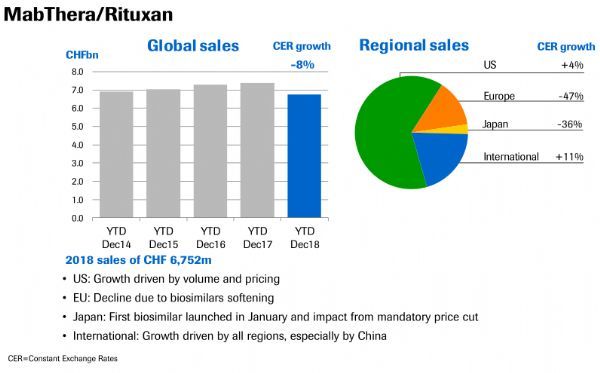
2019年2月26日讯 /生物谷BIOON/ --2月22日,中国国家药品监督管理局(NMPA)批准上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(HLX-01,商品名:汉利康)上市注册申请。该药是国内获批的首个生物类似药,主要用于非霍奇金淋巴瘤的治疗。汉利康(HLX-01)是瑞士制药巨头罗氏三大王牌生物制剂之一——MabThera/Rituxan(中文商品名:美罗华,通用名:rituxima
治疗所有适应症 赫赛汀生物类似药获得FDA批准
日前,三星Bioepis宣布,FDA批准了Ontruzant(trastuzumab-dttb)的上市申请。Ontruzant是重磅乳腺癌疗法赫赛汀(Herceptin)的生物类似药(biosimilar),被批准用于治疗赫赛汀标签中的所有适应症,包括HER2阳性的早期乳腺癌,HER2阳性的转移性乳腺癌,和HER2阳性转移性胃癌(胃或食管-胃交界部腺癌)。值得一提的是,Ontruzan
剑指罗氏安维汀!信达生物贝伐珠单抗生物类似药IBI-305上市申请获中国NMPA受理
2019年01月30日讯 /生物谷BIOON/ --信达生物制药有限公司(以下简称信达生物,Innovent Biologics)近日宣布,中国国家药品监督管理局(NMPA)已受理该公司在研药物贝伐珠单抗注射液生物类似药(IBI-305)的新药上市申请(NDA)。这是继达伯舒®(信迪利单抗注射液, 于2018年12月24日正式获批上市)和阿达木单抗生物类似药(IBI-303)之后,该公司
罗氏王牌生物药赫赛汀面临围剿!美国第3款生物仿制药Ontruzant获批,来自默沙东
2019年1月21日讯 /生物谷BIOON/ --美国制药巨头默沙东(Merck & Co)与合作伙伴三星集团(Samsung)旗下生物制药公司三星Bioepis(Samsung Bioepis)合作开发的一款生物仿制药Ontruzant(trastuzumab-dttb,曲妥珠单抗)近日获得美国食品和药物管理局(FDA)批准。Ontruzant是美国市场获批的第17个生物仿制药,也是获批
600亿生物类似药市场大爆发 本土第一款即将获批
美国FDA对生物类似药的定义是:与已批准的参比制剂高度相似的(highlysimilar)、没有临床意义上的差异的生物制品。2016年全球生物类似药市场规模约为16亿美元,而随着部分重磅生物原研药的专利陆续到期,生物类似药市场规模随着获批上市品种数量的持续增加也将迎来日益繁荣。据Evaluate预测,2022年全球生物类似药市场规模将达到90亿美元(约合615亿元人民币),是2016年
三生制药与三星Bioepis签订生物类似药合作协议
中国领先的生物制药企业三生制药(01530.HK)今天宣布与三星Bioepis(“Samsung Bioepis”)达成一项合作协议,将在中国大陆(不包括香港、澳门和台湾地区)进行三星Bioepis多个生物类似药在研产品的临床研发和商业化,其中包括贝伐珠单抗的生物类似药在研产品SB8。“三星Bioepis具有全球市场领先的生物制品研发和生产实力,结合三生制药在中国的整合平台优势,双方将为中国患者提
FDA生物类似药开发及生物制品价格竞争与创新法案问答之一
与欧盟相比,美国生物类似药的发展起步较晚,但2018年绝对是美国生物类似药的丰收年,从2015年3月诺华山德士获批的第一个生物类似药Zarxio(filgrastim -sndz)至今,目前FDA共计批准了15种生物类似药,其中,在2018年获批的就达7种,创造了历史新纪录。此外,目前还有60多个生物类似项目正在进行中。2018年7月18日FDA发布《生物类似药行动计划》(Biosim