历史性突破!优时比抗炎药Cimzia获美FDA批准:首个非放射学中轴型脊柱关节炎(nr-axSpA)药物
2019年03月29日讯 /生物谷BIOON/ --比利时制药巨头优时比(UCB)近日宣布,美国食品和药物管理局(FDA)已批准Cimzia(certolizumab pegol,赛妥珠单抗)一个新的适应症,用于存在炎症体征的活动性非放射学中轴型脊柱关节炎(nr-axSpA)成人患者的治疗。此次批准,使Cimzia成为首个也是唯一一个获得FDA批准治疗nr-axSpA的药物。nr-axSpA是一种
15年来重大进展!诺华Mayzent获美国FDA批准,首个活动性继发进展型多发性硬化症(SPMS)口服药物
2019年3月27日讯 /生物谷BIOON/ --瑞士制药巨头诺华(Novartis)近日宣布,美国食品和药物管理局(FDA)已批准Mayzent(siponimod),用于复发型多发性硬化症(MS)成人患者的治疗,包括活动性继发进展型多发性硬化症(SPMS)、复发缓解型多发性硬化症(RRMS)、临床孤立综合征(CIS)。Mayzent预计将在大约一周内在美国上市。用药方面,患者不需要首次给药观察
药明生物祝贺Amicus新一代庞贝氏症疗法获FDA突破性疗法认定
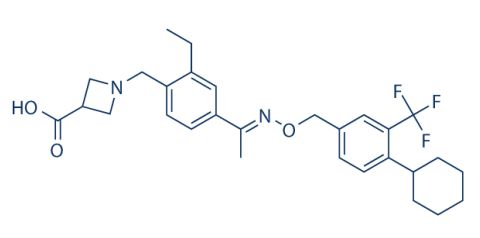
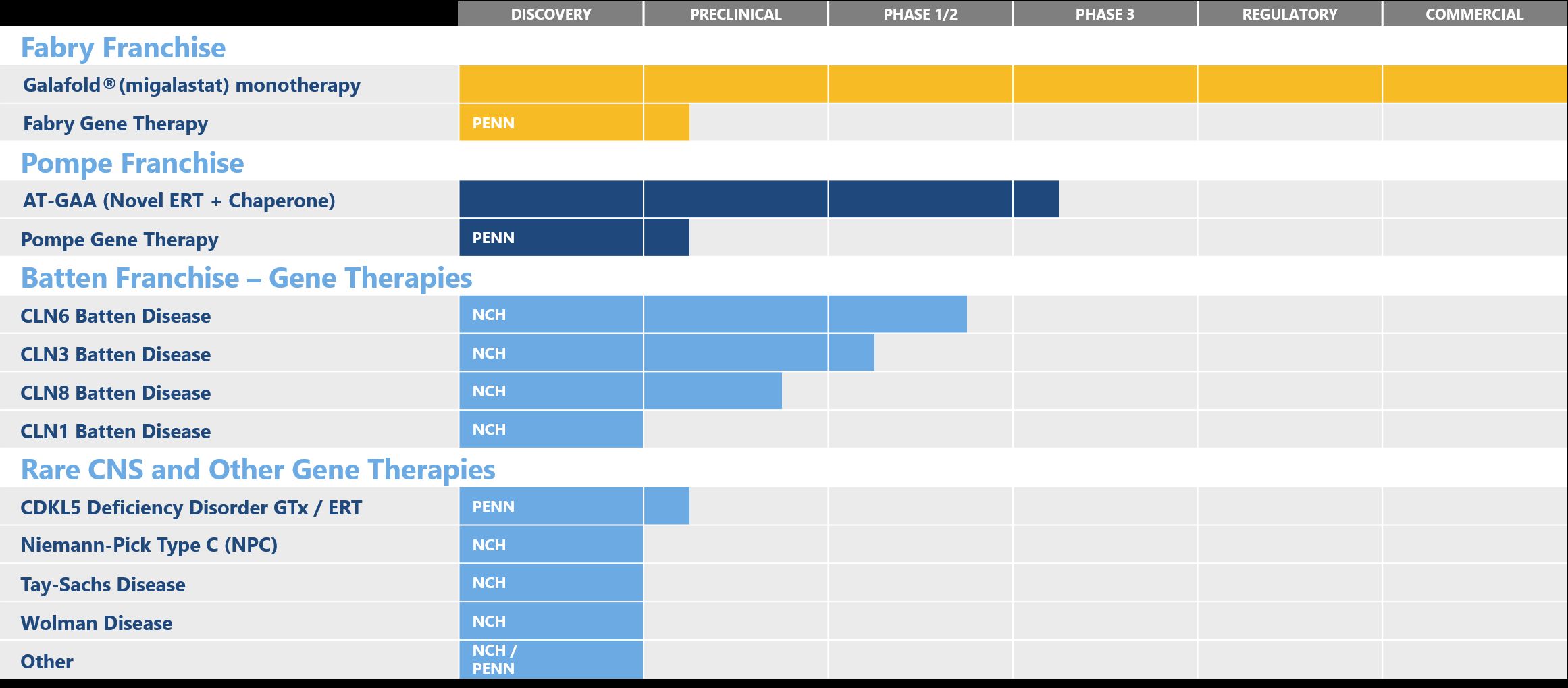
全球领先的开放式生物制药技术平台公司药明生物(WuXi Biologics, 2269.HK)的合作伙伴Amicus(纳斯达克股票代码:FOLD)近日宣布,公司用于治疗晚发型庞贝氏症的新一代疗法AT-GAA(ATB200/AT2221)获美国FDA授予突破性疗法认定。药明生物对此表示热烈祝贺。庞贝氏症是由酸性α-葡萄糖苷酶(GAA)缺乏而引起的一种遗传性溶酶体贮积症(LSD)。AT-GAA是首个获
核苷组合疗法MT1621获FDA突破性疗法认定
日前,Modis Therapeutics公司宣布,该公司用于治疗胸苷激酶2缺乏症(TK2d)的在研疗法MT1621获得FDA授予的突破性疗法认定。这一资格认定将加快MT1621的开发和审评过程。TK2d是一种线粒体DNA(mtDNA)耗竭综合征(MDD)。线粒体是细胞中的能量工厂,它携带的线粒体DNA编码帮助产生能量的蛋白。在TK2d患者中,由于胸苷激酶2的缺失,用于生成mtDNA的
Hepatology:一种新型的组合性免疫疗法有望阻断肝癌的进展
2019年3月15日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Hepatology上的研究报告中,来自加利福尼亚大学Moores癌症研究中心的科学家们通过研究发现,将一种合成性的dsRNA聚胞苷酸(dsRNA-polylC)和程序性死亡配体1抗体(PD-L1抗体)相结合或有望有效阻断小鼠模型肝细胞癌的进展,并能促进部分小鼠模型机体中的肿瘤完全缓解以及保持无肿瘤存活状态。图片来源:hi
显著改善慢性肝病 口服新药seladelpar获得FDA突破性疗法认定
近日,美国FDA授予CymaBay Therapeutics公司的临床3期在研药seladelpar突破性疗法认定,用于与熊去氧胆酸(ursodeoxycholic acid,UDCA)联合用药治疗对UDCA反应不足的原发性胆汁性胆管炎(PBC)成人患者,以及作为单药疗法治疗无法耐受UDCA的PBC成人患者。原发性胆汁性胆管炎是一种有潜在生命危险的肝脏自身免疫性疾病。由于免疫系统持续攻
艾伯维首创靶向抗癌药Venclexta获美国FDA授予第5个突破性药物资格
2019年03月09日/生物谷BIOON/--生物技术巨头艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已授予靶向抗癌药Venclexta(venetoclax)突破性药物资格(BTD),联合Gazyva(obinutuzumab)作为一种固定疗程的组合方案,用于未经治疗的慢性淋巴细胞白血病(CLL)成人患者。值得一提的是,此次BTD也是Venclexta在美国FDA方面获得的第5
Zanubrutinib诞生记:首获FDA突破性疗法认定的本土抗癌药
今年1月,一条喜讯在医药人的朋友圈刷屏:美国FDA宣布,授予百济神州BTK抑制剂zanubrutinib突破性疗法认定,用于治疗经治的成年套细胞淋巴瘤(MCL)患者。这是中国本土研发的抗癌疗法首次获得FDA突破性疗法认定,堪称“零的突破”。60年前的意外发现1952年,一名8岁的男孩被送到了儿科医生欧格登·布鲁顿(Ogden Bruton)这里。这名年轻的病人体内反复被肺炎球菌所感染,
Amicus公司庞贝氏症二代疗法AT-GAA斩获美国FDA突破性药物资格
2019年02月28日/生物谷BIOON/--Amicus Therapeutics是一家专注于发现、开发和商业化新型高质量药物用于治疗罕见代谢性疾病的生物技术公司。近日,该公司宣布,美国食品和药物管理局(FDA)已授予AT-GAA治疗晚发型庞贝氏症(late onset Pompe disease,LOPD)的突破性药物资格(BTD)。值得一提的是,AT-GAA是有史以来第一个获得BTD的庞贝氏
CymaBay新型强效PPARδ激动剂seladelpar获美国FDA突破性药物资格
2019年2月25日讯 /生物谷BIOON/ --CymaBay Therapeutics是一家临床阶段的生物制药公司,专注于开发治疗肝脏和其他慢性病的创新疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予seladelpar联合熊去氧胆酸(ursodeoxycholic acid,UDCA)治疗早期原发性胆汁性胆管炎(PBC)成人患者的突破性药物资格(BTD)。seladelpar是一