肝病疗法elafibranor获FDA突破性疗法认定 即将进入3期临床
今日,Genfit公司宣布该公司的主打产品elafibranor获得美国FDA授予的突破性疗法认定,用于治疗原发性胆汁性胆管炎(PBC)成人患者。这些患者对熊去氧胆酸(UDCA)反应不良。Elafibranor是一款“first-in-class”PPARα/δ激动剂,在治疗PBC患者的2期临床试验中表现出积极疗效,它同时在3期临床试验中治疗非酒精性脂肪性肝炎(NASH)患者。PBC是
首创PPARα/δ双重激动剂elafibranor治疗原发性胆汁性胆管炎(PBC)获突破性药物资格
2019年4月21日讯 /生物谷BIOON/ --Genfit是一家处于后期临床阶段的生物制药公司,致力于发现和开发创新的治疗和诊断解决方案,用于代谢和肝脏相关疾病领域。近日,该公司宣布,美国FDA已授予其先导候选药物PPARα/δ双重激动剂elafibranor突破性药物资格(BTD),用于治疗对熊去氧胆酸(UDCA)反应不足的原发性胆汁性胆管炎(PBC)成人患者。BTD是FDA在2012年创建
FDA授予PB2452突破性疗法认定 用于止血
PhaseBio Pharmaceuticals宣布,其创新疗法PB2452斩获美国FDA授予的突破性疗法认定,用于逆转抗凝血剂ticagrelor的效果,以在临床上进行紧急止血。Ticagrelor是一款由阿斯利康带来的新药,它能有效预防血小板聚集形成血栓,因此能够保护急性冠状动脉综合征患者,减少他们死亡、心脏病、以及中风的风险。由于其有效性,美国和欧洲的多个协会指南推荐它作为急性冠
两款创新机制抗癌疗法获日本“突破性疗法”认定
今日,第一三共(Daiichi Sankyo)宣布,其用于治疗复发/难治性(r/r)外周T细胞淋巴瘤(PTCL)的组蛋白赖氨酸甲基转移酶(Histone-Lysine N-methyltransferase,EZH)1/2双重抑制剂valemetostat,获得了日本厚生劳动省颁发的SAKIGAKE(先驱)认定。而在一天前,Rakuten Medical也宣布,其用于治疗头颈癌的在研光
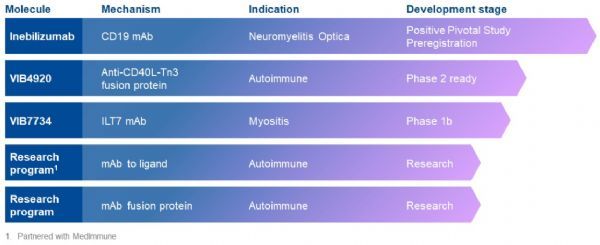
inebilizumab治疗神经脊髓炎频谱障碍(NMOSD)获美FDA突破性药物资格
2019年4月21日讯 /生物谷BIOON/ --Viela Bio总部位于美国马里兰州的盖瑟斯堡,该公司是从英国制药巨头阿斯利康(AstraZeneca)旗下全球生物制品研发部门MedImmune拆分出来的一家临床阶段生物制药公司,专注于炎症和自身免疫性疾病领域的创新药物开发。近日,该公司宣布,美国食品和药物管理局(FDA)已授予抗CD19单抗inebilizumab(前称MEDI-551)治疗
多篇文章解析致癌关联性研究进展!
提起致癌,可能很多人会将其与化学物质、辐射等因素联系起来,近年来科学家们在致癌研究领域进行了大量研究,以下这些致癌相关的研究成果或许你需要了解一下。【1】Cell:新研究揭示环境致癌物的独特突变特征,有助揭示癌症病因doi:10.1016/j.cell.2019.03.001对人类肿瘤进行全基因组测序(whole-genome-sequencing, WGS)可显示出独特的突变模式,这些突变模式有
诱导性多能干细胞最新研究进展(第2期)
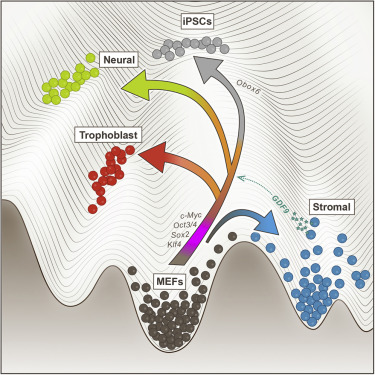
2019年4月27日讯/生物谷BIOON/---诱导性多能干细胞(iPS细胞)最初是日本科学家山中伸弥(Shinya Yamanaka)团队在2006年利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入到小鼠胚胎或皮肤纤维母细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型。这些ips细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤
2019中国创新药全球化布局 信达等企业取得突破性进展
选择去海外开展新药临床试验,是当前中国创新药公司进行国际化布局的一大风景。进入2019年以来,包括信达生物、天境生物、百济神州、丹诺医药等在内的很多家新锐企业在海外的临床研究获得了突破性进展。以天境生物为例,进入2019年,该公司已至少宣布了海外的三项临床进展,就在几日前,其自主研发的针对自身免疫类和炎症类疾病的抗体药TJM2于美国完成1期临床试验首次健康受试者用药。再以百济神州为例,
CGRP偏头痛领域最新进展:梯瓦终止Ajovy治疗丛集性头疼III期临床项目开发
2019年04月24日讯 /生物谷BIOON/ --以色列制药巨头梯瓦(Teva)近日宣布,终止偏头痛药物Ajovy(fremanezumab)治疗丛集性头痛(cluster headaches,CH)的临床开发项目。该决定是基于对一项发作性丛集性偏头疼(episodic cluster headaches,ECH)III期研究数据开展的一次预先指定的无效性分析。分析显示,该研究不太可能达到主要终
填补心衰疗法空白 突破性医疗器械获得FDA批准上市
日前,开发植入性治疗心力衰竭医疗器械的Impulse Dynamics公司,宣布美国FDA批准它开发的“first-in-class”Optimizer智能系统,用于治疗不适用于接受其它医疗器械治疗的中重度慢性心衰患者。Optimizer智能系统在2015年获得了FDA授予的突破性医疗器械认定。值得注意的是,这款创新心衰解决方案已经在中国获得批准,中国的心衰患者已经能够使用这款医疗器械