ALKS3831(奥氮平/samidorphan)III期临床显著改善疾病症状和严重程度!
2020年03月08日讯 /生物谷BIOON/ --Alkermes是一家全面整合的爱尔兰生物制药公司,致力于开发治疗中枢神经系统(CNS)疾病和肿瘤的创新药物。近日,该公司宣布,评估抗精神病药物ALKS3831(olanzapine/samidorphan)治疗精神分裂症急性加重期患者III期ENLIGHTEN-1临床试验的结果已发表于同行评议期刊《临床精
强生S1P1调节剂ponesimod申请上市,III期疗效击败赛诺菲Aubagio(奥巴捷)!
2020年3月5日讯 /生物谷BIOON/ --强生(JNJ)旗下杨森制药近日宣布,已向欧洲药品管理局(EMA)提交了一份营销授权申请(MAA),寻求批准ponesimod用于复发型多发性硬化症(RMS)成人患者的治疗。ponesimod是一种新型、口服、选择性鞘氨醇-1-磷酸受体1(S1P1)调节剂,可功能性抑制S1P蛋白的活性,并将淋巴细胞束缚在淋巴结内
基因免疫治疗新药被“保送” 直击奥希替尼耐药难题
EGFR靶向治疗出现耐药是躲不掉的难题,尤其是三代药奥希替尼(泰瑞沙,AZD9291)耐药后十分棘手,成为广大肺癌患者关注的热点和难点。最近随着一款新药的"保送",这一难题终于迎来新的解决方案。FDA授予Oncoprex联合奥希替尼快速通道审批资格,用于治疗奥希替尼耐药后的EGFR突变晚期非小细胞肺癌(NSCLC),这意味着无需经过漫长的审批流程,Oncop
再鼎医药甲苯磺酸奥玛环素(omadacycline)新药上市申请获国家药监局(NMPA)受理!
2020年02月12日讯 /生物谷BIOON/ --再鼎医药(Zai Lab)近日宣布,国家药品监督管理局(NMPA)已受理其甲苯磺酸奥玛环素(Omadacycline)的新药上市申请,用于治疗社区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI)。再鼎医药创始人兼首席执行官杜莹博士表示:“此次新药上市申请的受理,意味着我们朝着成为一
ALKS3831(奥氮平/samidorphan)在美国进入审查,治疗精神分裂症和双相I型障碍
2020年01月29日讯 /生物谷BIOON/ --Alkermes是一家全面整合的爱尔兰生物制药公司,致力于开发治疗中枢神经系统(CNS)疾病和肿瘤的创新药物。近日,该公司宣布,美国食品和药物管理局(FDA)已受理ALKS3831(olanzapine/samidorphan)的新药申请(NDA),这是一种新型口服非典型抗精神病药物,每日一次,用于治疗精神
FDA延后Intercept潜在首款NASH新药奥贝胆酸的审评决定日期
日前,Intercept Pharmaceuticals发布公告,宣布美国FDA延后了其潜在首款NASH新药奥贝胆酸(OCA)的审评决定日期。对于迟迟未见创新疗法问世的NASH领域,可谓是好事多磨。作为一种强力的特异性法尼醇X受体(FXR)激动剂,奥贝胆酸先前在一项名为REGENERATE的3期临床试验中取得了积极的结果。试验结果表明,在接受治疗18个月时,
PARP抑制剂奥拉帕利前列腺癌适应症上市申请获优先审评
1月20日,阿斯利康和默沙东宣布,Lynparza(olaparib)的补充新药申请已获美国受理并授予优先审查资格,用于转移性去势抵抗性前列腺癌(mCRPC),携带有害或疑似有害生殖系或同源重组修复基因突变(HRRm)患者,这些患者既往接受新型激素药物治疗后发生疾病进展。PDUFA日期设定为2020年第二季度。FDA的优先审查是基于临床3期PROfound试
奥拉帕利组合疗法获优先审评资格,一线维持治疗特定晚期卵巢癌患者
今日,阿斯利康(AstraZeneca)和默沙东(MSD)宣布,美国FDA已经接受奥拉帕利(olaparib,英文商品名Lynparza)的补充新药申请,并且授予其优先审评资格,联合贝伐珠单抗(bevacizumab),用于对含铂化疗药完全或部分应答的晚期卵巢癌患者的一线维持治疗。如果获得批准,这将是Lynparza在美国获批治疗卵巢癌的第4个适
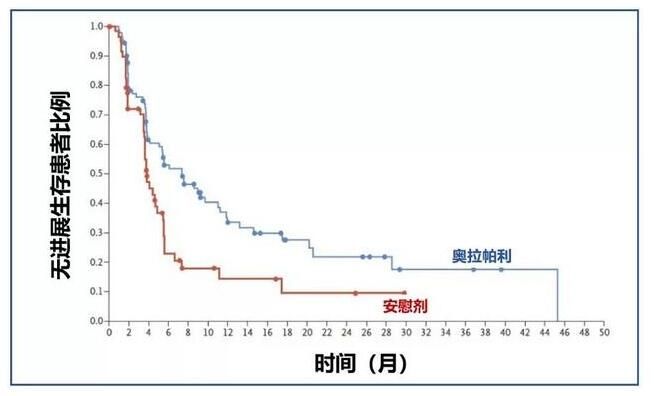
奥拉帕利又一适应症获批:用于胚系BRCA突变转移性胰腺癌患者的一线维持疗法
12月30日,阿斯利康与默沙东联合宣布,奥拉帕利在美国获批用于有害或疑似有害胚系BRCA突变(gBRCAm)转移性胰腺癌成年患者的一线维持治疗,这些患者在接受一线铂类化疗16周及以上仍未出现疾病进展。患者是否适用奥拉帕利将取决于FDA批准的伴随诊断的检测结果。这项批准遵循美国FDA肿瘤药物咨询委员会(ODAC)于12月17日发布的关于奥拉帕利用于此项适应症的
罗氏Xolair(奥马珠单抗)新适应症在美国进入审查,靶向阻断IgE缩小鼻息肉&改善症状!
2019年12月12日讯 /生物谷BIOON/ --罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已受理Xolair(omalizumab,奥马珠单抗)的一份补充生物制品许可申请(sBLA),用于对鼻内皮质类固醇治疗应答不足的18岁及以上成人患者,治疗鼻息肉。FDA预计在2020年第三季度做出批准该适应症的决定。鼻息肉是一种慢性疾病,常与其他呼吸