“first-in-class”多发性骨髓瘤创新疗法获FDA优先审评资格
日前,Oncopeptides AB公司宣布,美国FDA接受其为melflufen递交的新药申请(NDA),并且授予其优先审评资格。适应症为治疗对三重疗法耐药的多发性骨髓瘤(MM)患者,他们至少对一种蛋白酶体抑制剂,一种免疫调节剂和一种抗CD38单克隆抗体疗法产生耐药性。FDA预计将于明年2月28日之前做出回复。Melflufen是一款“firs
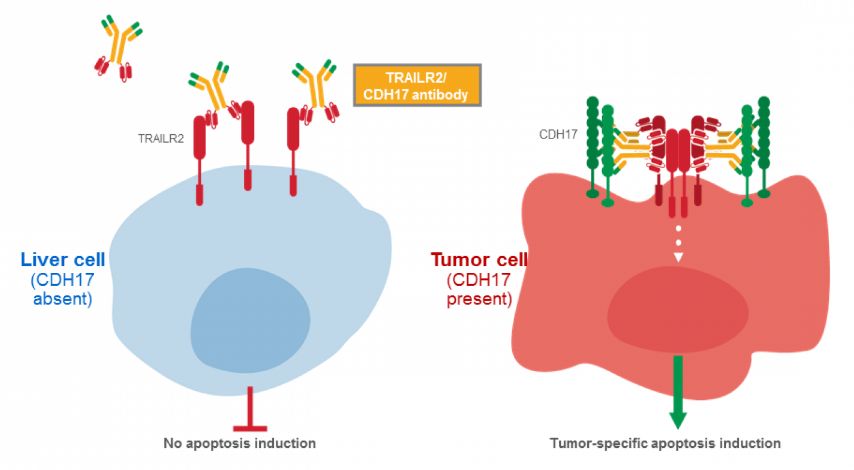
胃肠道癌创新疗法!勃林格殷格翰首创TRAILR2/CDH17双特异性抗体BI 905711进入人体临床试验!
BI 905711是一种双特异性、四价治疗性抗体,可激活TRAILR2/CDH17共表达癌细胞中的自毁(凋亡)通路。
获FDA优先审评资格 DMD创新疗法有望明年2月获批
Sarepta Therapeutics公司宣布,美国FDA已经接受该公司寻求加速批准casimersen(SRP-4045)的新药申请(NDA),并授予其优先审评资格,预计将在2021年2月25日之前做出回复。FDA同时表示,目前不打算成立咨询委员会来讨论该申请。Casimersen是一种磷酸二酰胺吗啉寡聚物(PMO),用于治疗特定杜氏肌营养不良(DMD)
斩获FDA优先审评资格 法布里病创新疗法有望明年初获批
Protalix BioTherapeutics公司与其合作伙伴Chiesi Global Rare Diseases公司今天宣布,美国FDA已经接受了为pegunigalasidase-α递交的生物制品许可申请(BLA),并授予其优先审评资格,适应症为成人法布里病(Fabry Disease)患者。Pegunigalasidase-α是该公司设
峰回路转 微生物组创新疗法达到关键性3期临床终点
今日,Seres Therapeutics宣布,该公司开发的微生物组疗法SER-109,在治疗复发性艰难梭菌感染(CDI)的关键3期临床试验ECOSPOR III中获得积极顶线结果。该研究显示,与安慰剂相比,SER-109导致给药8周内CDI出现复发的患者比例显着下降,疗效结果超过之前与美国FDA协商确定的阈值。Seres计划依据这一临床结果,向
血友病创新疗法!诺和诺德concizumab皮下注射预防性治疗A型/B型血友病III期项目恢复!
concizumab是抗TFPI单抗,具有独特机制,无论患者抑制剂状态如何,均有疗效。
FDA批准创新嗜睡症疗法上市
Jazz Pharmaceuticals今天宣布,美国食品药品监督管理局(FDA)于2020年7月21日批准Xywav(钙、镁、钾和羟丁酸钠)口服液上市,用于治疗7岁及以上发作性睡病患者的猝倒症或白天过度嗜睡(EDS)。Xywav是一种羟丁酸钠产品,其独特的阳离子组成导致钠含量比目前治疗这些患者的标准疗法羟丁酸钠低92%,降低患者钠离子摄入过量的