中国生物研制治疗性新冠特免血浆制品投入临床,救治重症患者!
2020年02月14日讯 /生物谷BIOON/ --2月13日晚,国药集团中国生物(CNBG)发布了在新冠肺炎治疗方面的重磅消息:国药中国生物已完成对部分康复者血浆的采集工作,开展新冠病毒特免血浆制品和特免球蛋白的制备。经过严格的血液生物安全性检测,病毒灭活,抗病毒活性检测等,已成功制备出用于临床治疗的特免血浆,在中国生物武汉生物制品研究所、国药集团武汉血液
2020版《中国药典》重组治疗性生物制品命名原则拟修订
2019年12月09日,密切围绕"国家药品安全十三五规划"的总体目标,以建立"最严谨的标准"为准则,为进一步完善生物制品通用名称命名原则,规范重组治疗性生物制品通用名称,保证对上市药品全生命周期追溯和药物警戒监管,避免"一药多名"或不同药品采用同一通用名称的混淆,经第十一届药典委员会相关专业委员会审议,拟对《中国药典》2015年版第一
FDA批准第25个生物类似药 持续推动生物制品可及性
纽约当地时间11月18日,辉瑞公司宣布,FDA已批准该公司申报的Abrilada (adalimumab-afzb)上市。Abrilada是一款Humira(adalimumab)的生物类似药,该药物的获批,也使得辉瑞公司拥有的获批生物类似物达到6个,成为拥有最多生物类似药产品组合的公司之一。在Abrilada 获批之前,FDA药品审评与研究中心(CDER)生物制品与生物类似药办公室代
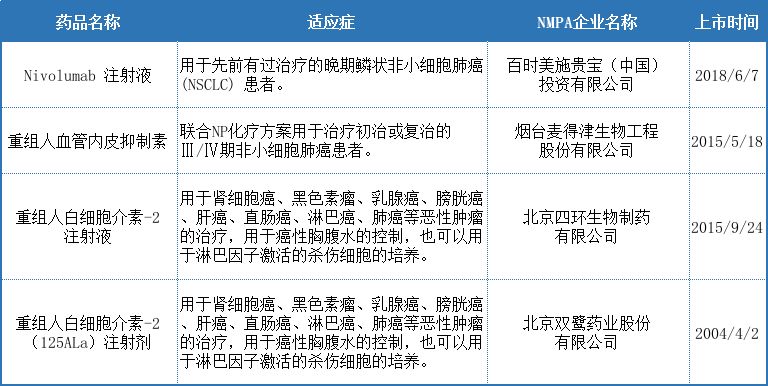
国内治疗肺癌的生物制品
肺癌发生于支气管黏膜上皮,近50年来肺癌的发病率显着增高,在欧美工业发达国家和我国的一些工业大城市中,肺癌发病率在男性恶性肿瘤中已居首位,在女性发病率也迅速增高,占女性常见恶性肿瘤的第2位或第3位。从1996年开始,支气管肺癌已上升为中国人群肿瘤的第1位死因,其俨然成为危害生命健康的一种主要疾病。随着医学的研究和发展,医生专家们提出:如果有毒性很低的药物,并且对于肿瘤的治疗十分有效,我
赛默飞液质联用平台对核酸类生物医药制品的全表征
FDA生物类似药开发及生物制品价格竞争与创新法案问答之一
与欧盟相比,美国生物类似药的发展起步较晚,但2018年绝对是美国生物类似药的丰收年,从2015年3月诺华山德士获批的第一个生物类似药Zarxio(filgrastim -sndz)至今,目前FDA共计批准了15种生物类似药,其中,在2018年获批的就达7种,创造了历史新纪录。此外,目前还有60多个生物类似项目正在进行中。2018年7月18日FDA发布《生物类似药行动计划》(Biosim
《生物制品批签发管理办法》发布
《生物制品批签发管理办法》已于2017年12月20日经国家食品药品监督管理总局局务会议审议通过,现予公布,自2018年2月1日起施行。局长:毕井泉2017年12月29日生物制品批签发管理办法第一章 总 则第一条 为加强生物制品监督管理,规范生物制品批签发行为,保证生物制品安全、有效,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)有关规定,制定本办法。第二条 本办
FDA再次延迟Portola公司AndexXa生物制品许可申请
辉瑞与百时美施贵宝,以及拜耳与强生都希望听到他们各自的血液稀释剂Eliquis和Xarelto作为一种解毒剂能够在明年早期获得批准。然而在FDA再次推迟对AndexXa的审评后,他们的等待看来至少要到春季了。AndexXa是由Portola制药公司研发的一种针对凝血因子Xa抑制剂的解毒剂。这个加利福尼亚州的生物技术公司上周向投资者表示,FDA已经将AndexXa的评审日期从2018年2月3日推迟到
上海优先发展生物制品,加快免疫细胞治疗、干细胞、基因治疗相关技术研究,9月1日开始实施。
近日,上海市人民政府办公厅正式发布《关于促进本市生物医药产业健康发展的实施意见》。文中明确:优先发展生物制品,加快免疫细胞治疗、干细胞、基因治疗相关技术研究,2017年9月1日开始实施。
2016年生物制品批签发年报:白蛋白和凝血因子VIII仍非常紧缺
我国自2006 年起对疫苗和血液制品全面实施批签发制度。目前,我国纳入批签发管理的生物制品包括全部疫苗类制品、国产血液制品和进口人血白蛋白、血源筛查用体外诊断试剂(简称“血筛试剂”)。2016 年,经CFDA研判,决定对乙肝/丙肝/艾滋核酸检测血筛试剂实施批签发管理。7月4日,CFDA官网发布了中国食品药品检定研究院编写的《2016年生物制品批签发年报》。这份报告也是了解国