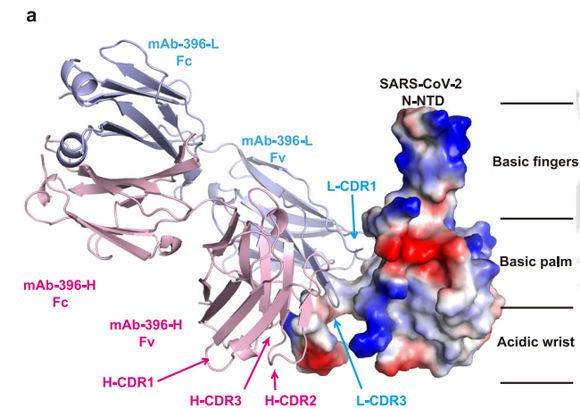
研究发现首个可抑制COVID-19补体过度激活的全人源新冠病毒N蛋白抗体
新型冠状病毒肺炎(COVID-19)疫情给人民健康与生活带来了严峻挑战。流行病学分析显示,该病重症患者死亡率高达49%。多个临床实验数据表明:抑制补体的过度激活将有助于改善重症患者的临床预后。研究表明,SARS-CoV-2核衣壳蛋白(nucleocapsid,N蛋白)能通过MASP-2激活补体系统加剧COVID-19患者的肺部损伤。尽管目前针对该疾病重症化进
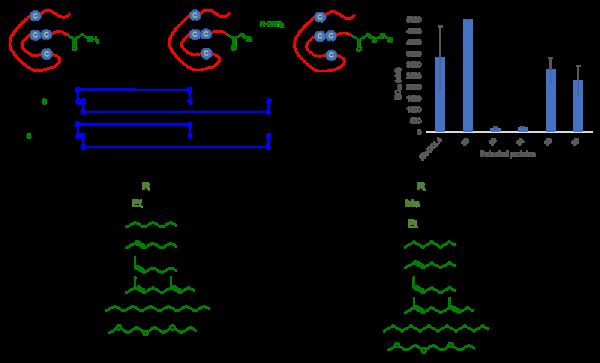
蛋白质N-端选择性仿生转氨化合成抗HIV药物研究取得进展
蛋白质的定点修饰是通过化学反应对蛋白质特定位点进行修饰,从而达到对蛋白质改性或对其进行标记等一系列目的。蛋白质的定点修饰对反应条件严格:反应需在水相溶液中进行,同时蛋白质其它侧链基团不参与反应。近日,上海交通大学特别研究员王平课题组与中国科学院昆明动物研究所研究员郑永唐课题组合作,发展了一种由仿生的邻醌介导对蛋白N-端进行选择性修饰的
研究揭示N-糖基化修饰促进灵芝免疫调节蛋白的抗炎活性及其作用机制
Food & Function (2021,12, 3393-3404)在线发表上海交通大学农业与生物学院周选围教授课题组的研究论文“N-Glycosylated Ganoderma lucidum immunomodulatory protein improved anti-inflammatory activity via
Sci Signal: GRK5 N末端多肽可缓解超负荷心肌肥大和心力衰竭
基因表达的异常变化是导致超负荷心力衰竭,从而导致适应不良的心脏肥大,心室重构和收缩功能障碍的基础。此前研究表明,G蛋白Gq产生的细胞内信号会触发适应不良和心力衰竭,其中部分是通过激活G蛋白偶联受体激酶5(GRK5)引起的。肥大性刺激诱导心肌细胞核中GRK5的积累,并通过多种转录因子(包括NFAT)调节病理性基因的表达。 此外,研究表明GRK5的向细胞核转运的
PLoS Pathog:抗碳水化合物抗体2G12交叉中和HIV-1和H3N2病毒,有望作为对抗有包膜RNA病毒的通用抗体
2021年4月8日讯/生物谷BIOON/---从HIV-1感染者身上发现的广泛中和抗体(bnAb)有助于设计和开发HIV-1候选疫苗和药物。其中的许多抗体已经显示出对不同HIV-1毒株和亚型的显著效力和广度。其中的一类不寻常的bnAb是专门靶向HIV-1包膜糖蛋白(Env)上的聚糖屏障(glycan shield)的抗碳水化合物抗体。虽然HIV-1 Env上
Cell:N末端结构域抗原图谱揭示SARS-CoV-2的脆弱位点
2021年3月23日讯/生物谷BIOON/---科学家们了解到,抗击COVID-19感染的抗体识别出了大流行冠状病毒SARS-CoV-2的一个较少研究的区域。这些抗体在以前感染患者的血液样本中被发现,并被发现能有效地防止病毒感染细胞。SARS-CoV-2刺突蛋白是打开细胞大门的钥匙,抗体与刺突蛋白结合来阻断这一功能。人们对研究靶向刺突蛋白的受体结合结构域(R
N-取代-α-氨基酸酯的不对称合成研究获进展
N-取代-α-氨基酸及其衍生物是许多生物活性物质的关键结构单元,如多肽或模拟肽的N-甲基化衍生物往往具有更好的代谢稳定性、细胞膜通透性及口服生物利用度。然而,已报道的酶促不对称合成N-取代-α-氨基酸的方法存在只能合成(S)-构型产物、底物谱窄等问题。中国科学院天津工业生物技术研究所研究员朱敦明、吴洽庆带领的生物催化与绿色
Cell:新冠病毒N439K变种在毒力和传播能力上与野生型病毒相似,但能更强地结合人ACE2受体
2021年2月4日讯/生物谷BIOON/---在一项新的研究中,一个国际研究小组描述了SARS-CoV-2刺突蛋白(S蛋白)中一个氨基酸变化(N439K)的影响和分子机制。携带这种突变的SARS-CoV-2既常见又在全球范围内迅速传播。相关研究结果于2021年1月28日在线发表在Cell期刊上,论文标题为“Circulating SARS-CoV-2 spi
鞭毛膜蛋白N-糖基化修饰调控鞭毛粘附能力研究取得进展
鞭毛也称纤毛,是指突出在真核细胞表面,基于微管的一类细胞器,广泛分布于原生动物和脊椎动物中,具有运动、感受和分泌功能。在液体中,生物的鞭毛通过摆动来驱动细胞本身或液体的运动。有趣的是,生活在潮湿环境中的原生生物如莱茵衣藻还可以通过滑行(gliding)沿着固体表面运动。莱茵衣藻的滑行分为两个步骤:第一步鞭毛粘附在固体表面上,两根鞭毛形成夹角为180°的构象;
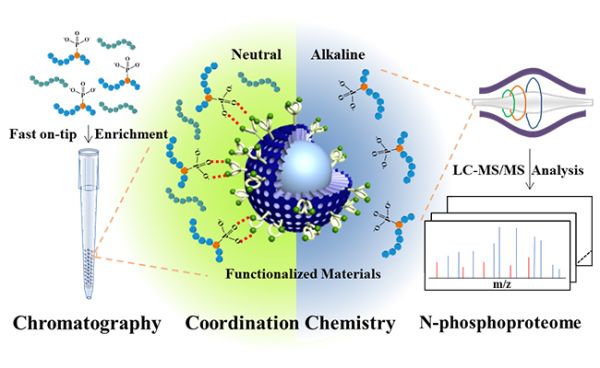
研究开发N-磷酸化蛋白质组深度覆盖分析新方法
近日,中国科学院大连化学物理研究所生物分子高效分离与表征研究组研究员张丽华和中科院院士张玉奎团队,发展出N-磷酸化肽段高选择性富集新方法,并结合肽段的高效分离和高灵敏度鉴定,实现了N-磷酸化蛋白质组的深度覆盖分析。与研究相对深入的发生在丝氨酸、苏氨酸和酪氨酸侧链氨基上的蛋白质O-磷酸化修饰相比,发生在蛋白质组氨酸、精氨酸和赖氨酸上的N-磷酸化修饰,由于P-N