多尺度生物工程支架革新造血干细胞扩增与脑类器官功能,赋能再生医学与新型生物计算
多尺度生物工程支架可精准模拟造血干细胞微环境实现高效扩增,优化脑类器官发育与功能整合,为再生医学治疗及新型生物计算设备研发提供核心技术支撑。
2025-11-18
25癌种5734个样本分析结果显示,瘤内微生物远低于既往报道,癌症与微生物组的关系或被动摇
根据本研究的结论,肿瘤中微生物的存在远少于此前研究报道,TCGA数据集中已确定的很多物种可能根本不存在。
2025-09-19
Agave Group 在安高若"Bee in Motion" 健康节展示前沿生物活性配方
意大利跨国健康公司 Agave Group 参加了 安高若主办的 "Bee in Motion" 健康节,展示了其最新研发的、支持运动健康,以及女性激素平衡和泌尿系统健康的临床级配方。
2025-10-31
Cell:肠道微生物组不稳定与儿童生长不良有关
这项发表在《细胞》杂志上的研究成果,建立了一个儿科微生物基因组库——这是一个公共健康数据库,包含了从8名马拉维儿童近一年内收集的粪便样本中提取的986种微生物的完整基因图谱。
2025-09-27
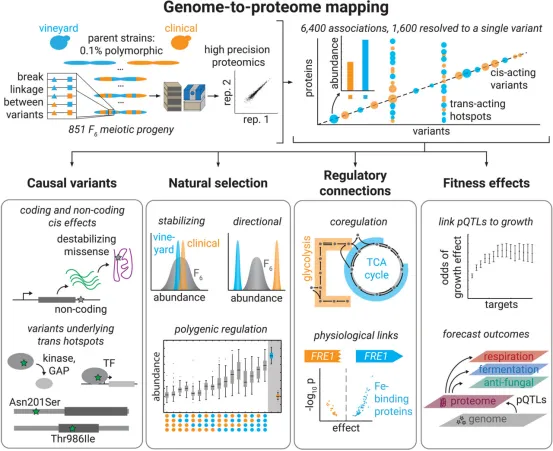
Science:蛋白质组分析可以预测酵母突变的生物学效应
2025-10-30
以创新为翼,书写制药新篇章
为鼓励制药行业原创撰稿人持续产出精品内容,制药在线(www.cphi.cn)联合“制药行业原创内容平台联盟”举办第七届制药原创文章金笔奖(简称“金笔奖”),共同构建行业知识分享生态圈。
2025-03-31
近期科学家们在肠道微生物研究领域取得的新成果!
2025-10-30