Cell:通过CRISPR筛选鉴定出抵抗新冠病毒感染的基因和药物靶标
来源:本站原创 2020-10-31 19:32
2020年10月31日讯/生物谷BIOON/---在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的所有基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭
2020年10月31日讯/生物谷BIOON/---在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭示了人类基因组中的哪些基因和基因调控网络是SARS-CoV-2感染所需的,抑制这些基因赋予了对这种冠状病毒感染的抵抗力。他们描述了一系列以前没有被认为是SARS-CoV-2治疗靶点的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Identification of required host factors for SARS-CoV-2 infection in human cells”。
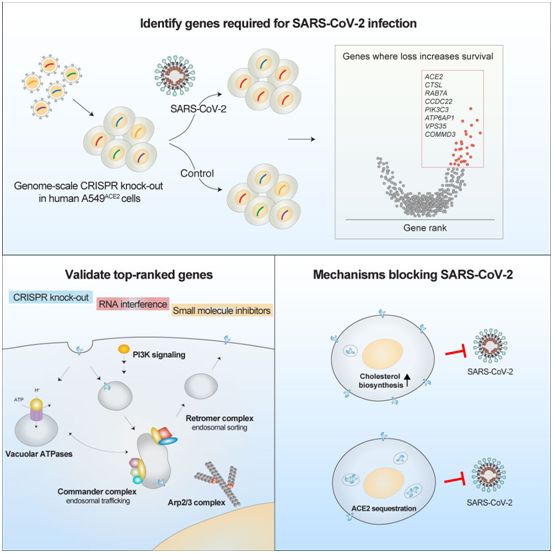
为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。
论文共同通讯作者、纽约基因组中心核心成员和纽约大学生物学助理教授Neville Sanjana博士说,“看到COVID-19在纽约和全世界造成的悲剧性影响,我们觉得可以利用我们已经应用于其他疾病的高通量CRISPR基因编辑工具,来了解SARS-CoV-2病毒所需的关键人体基因是什么。”此前,Sanjana博士已应用全基因组CRISPR筛选来识别不同疾病的遗传驱动因素,包括黑色素瘤的耐药性、免疫治疗失败、肺癌转移、先天性免疫、先天性代谢紊乱和肌肉萎缩症。
论文共同通讯作者、西奈山伊坎医学院微生物学教授Benjamin tenOever博士说,“我们之前在我们的研究工作中开发了一系列冠状病毒感染的人类细胞模型,以了解对病毒的免疫反应。能与Neville团队合作,从新的角度理解和全面剖析宿主基因是非常棒的。”
基因簇引领方向
这些作者发现,排名靠前的基因--那些发生丢失后可大幅降低病毒感染的基因---聚集在少数蛋白复合物中,包括空泡ATP酶、逆转运复合体(Retromer)、Commander、Arp2/3和PI3K。这些蛋白复合物中的许多都参与了将蛋白运往和运出细胞膜的过程。
论文共同第一作者、Sanjana实验室博士后研究员Zharko Daniloski博士说,“在我们的全基因组筛选中,我们非常高兴地看到同一家族中的多个基因排名靠前。这给了我们很大的信心,这些蛋白家族对病毒的生命周期至关重要,无论是进入人体细胞还是成功的病毒复制。”
在利用人肺部细胞进行CRISPR筛选的同时,这些作者还探讨了所需宿主基因的表达是肺部特异性还是更广泛的表达。在排名靠前的基因中,只有ACE2,即已知负责结合SARS-CoV-2病毒刺突蛋白的受体,表现出组织特异性表达,其余排名靠前的基因在许多组织中广泛表达,这表明这些机制可能独立于细胞或组织类型发挥作用。利用蛋白质组数据,他们发现,排名靠前的几个宿主基因直接与这种病毒自身的蛋白相互作用,这突显了它们在病毒生命周期中的核心作用。他们还分析了诸如寨卡病毒或H1N1大流行性流感病毒之类的其他病毒病原体所需的常见宿主基因。
机制上的新见解:胆固醇和病毒受体
在完成初步筛选后,这些作者使用了几种不同的技术来验证许多排名靠前的基因在病毒感染中的作用。他们利用来自肺部和其他易受SARS-CoV-2感染的器官的人类细胞系,测量了通过CRISPR进行基因敲除、使用RNA干扰进行基因抑制或药物抑制后的病毒感染情况。在验证了这些操作减少了病毒感染后,他们接下来试图了解这些基因的丢失阻止冠状病毒感染的机制。
利用最近开发的一种将大规模CRISPR编辑与单细胞RNA测序(ECCITE-seq)相结合的技术,这些作者发现几个排名靠前的基因的丢失会导致胆固醇生物合成途径的上调和细胞胆固醇的增加。利用这一见解,他们研究了氨氯地平(amlodipine)的影响,其中氨氯地平是一种改变胆固醇水平的药物。
论文共同第一作者、tenOever实验室博士后研究员Tristan Jordan博士说,“我们发现作为一种钙通道拮抗剂,氨氯地平能上调细胞胆固醇水平,阻断SARS-CoV-2感染。鉴于近期的临床研究也表明服用钙通道阻滞剂的患者具有下降的COVID-19病例死亡率,因此未来一个重要的研究方向将是进一步阐明胆固醇合成途径与SARS-CoV-2之间的关系。”
在之前关于刺突蛋白突变和病毒通过ACE2受体进入人体细胞的研究工作的基础上,这些作者还研究了一些基因的缺失是否可能通过降低ACE2水平来赋予SARS-CoV-2抵抗力。他们特别发现了一个基因,即RAB7A,它对ACE2转运到细胞膜上有很大影响。通过组合使用流式细胞仪和共聚焦显微镜,他们发现RAB7A的丢失通过封堵细胞表面上的ACE2受体来阻止病毒进入。
Sanjana博士说,“目前针对SARS-CoV-2感染的治疗方法目前主要针对这种病毒本身,但是这项研究提供了对宿主基因如何影响病毒进入的更好理解,并将为治疗发现提供新的途径,并有望加速易感人群的康复。”(生物谷 Bioon.com)
参考资料:
1.Zharko Daniloski et al. Identification of required host factors for SARS-CoV-2 infection in human cells. Cell, 2020, doi:10.1016/j.cell.2020.10.030.
2.CRISPR screen identifies genes, drug targets to protect against SARS-CoV-2 infection
https://phys.org/news/2020-10-crispr-screen-genes-drug-sars-cov-.html

图片来自Cell, 2020, doi:10.1016/j.cell.2020.10.030。
为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。
论文共同通讯作者、纽约基因组中心核心成员和纽约大学生物学助理教授Neville Sanjana博士说,“看到COVID-19在纽约和全世界造成的悲剧性影响,我们觉得可以利用我们已经应用于其他疾病的高通量CRISPR基因编辑工具,来了解SARS-CoV-2病毒所需的关键人体基因是什么。”此前,Sanjana博士已应用全基因组CRISPR筛选来识别不同疾病的遗传驱动因素,包括黑色素瘤的耐药性、免疫治疗失败、肺癌转移、先天性免疫、先天性代谢紊乱和肌肉萎缩症。
论文共同通讯作者、西奈山伊坎医学院微生物学教授Benjamin tenOever博士说,“我们之前在我们的研究工作中开发了一系列冠状病毒感染的人类细胞模型,以了解对病毒的免疫反应。能与Neville团队合作,从新的角度理解和全面剖析宿主基因是非常棒的。”
基因簇引领方向
这些作者发现,排名靠前的基因--那些发生丢失后可大幅降低病毒感染的基因---聚集在少数蛋白复合物中,包括空泡ATP酶、逆转运复合体(Retromer)、Commander、Arp2/3和PI3K。这些蛋白复合物中的许多都参与了将蛋白运往和运出细胞膜的过程。
论文共同第一作者、Sanjana实验室博士后研究员Zharko Daniloski博士说,“在我们的全基因组筛选中,我们非常高兴地看到同一家族中的多个基因排名靠前。这给了我们很大的信心,这些蛋白家族对病毒的生命周期至关重要,无论是进入人体细胞还是成功的病毒复制。”
在利用人肺部细胞进行CRISPR筛选的同时,这些作者还探讨了所需宿主基因的表达是肺部特异性还是更广泛的表达。在排名靠前的基因中,只有ACE2,即已知负责结合SARS-CoV-2病毒刺突蛋白的受体,表现出组织特异性表达,其余排名靠前的基因在许多组织中广泛表达,这表明这些机制可能独立于细胞或组织类型发挥作用。利用蛋白质组数据,他们发现,排名靠前的几个宿主基因直接与这种病毒自身的蛋白相互作用,这突显了它们在病毒生命周期中的核心作用。他们还分析了诸如寨卡病毒或H1N1大流行性流感病毒之类的其他病毒病原体所需的常见宿主基因。
机制上的新见解:胆固醇和病毒受体
在完成初步筛选后,这些作者使用了几种不同的技术来验证许多排名靠前的基因在病毒感染中的作用。他们利用来自肺部和其他易受SARS-CoV-2感染的器官的人类细胞系,测量了通过CRISPR进行基因敲除、使用RNA干扰进行基因抑制或药物抑制后的病毒感染情况。在验证了这些操作减少了病毒感染后,他们接下来试图了解这些基因的丢失阻止冠状病毒感染的机制。
利用最近开发的一种将大规模CRISPR编辑与单细胞RNA测序(ECCITE-seq)相结合的技术,这些作者发现几个排名靠前的基因的丢失会导致胆固醇生物合成途径的上调和细胞胆固醇的增加。利用这一见解,他们研究了氨氯地平(amlodipine)的影响,其中氨氯地平是一种改变胆固醇水平的药物。
论文共同第一作者、tenOever实验室博士后研究员Tristan Jordan博士说,“我们发现作为一种钙通道拮抗剂,氨氯地平能上调细胞胆固醇水平,阻断SARS-CoV-2感染。鉴于近期的临床研究也表明服用钙通道阻滞剂的患者具有下降的COVID-19病例死亡率,因此未来一个重要的研究方向将是进一步阐明胆固醇合成途径与SARS-CoV-2之间的关系。”
在之前关于刺突蛋白突变和病毒通过ACE2受体进入人体细胞的研究工作的基础上,这些作者还研究了一些基因的缺失是否可能通过降低ACE2水平来赋予SARS-CoV-2抵抗力。他们特别发现了一个基因,即RAB7A,它对ACE2转运到细胞膜上有很大影响。通过组合使用流式细胞仪和共聚焦显微镜,他们发现RAB7A的丢失通过封堵细胞表面上的ACE2受体来阻止病毒进入。
Sanjana博士说,“目前针对SARS-CoV-2感染的治疗方法目前主要针对这种病毒本身,但是这项研究提供了对宿主基因如何影响病毒进入的更好理解,并将为治疗发现提供新的途径,并有望加速易感人群的康复。”(生物谷 Bioon.com)
参考资料:
1.Zharko Daniloski et al. Identification of required host factors for SARS-CoV-2 infection in human cells. Cell, 2020, doi:10.1016/j.cell.2020.10.030.
2.CRISPR screen identifies genes, drug targets to protect against SARS-CoV-2 infection
https://phys.org/news/2020-10-crispr-screen-genes-drug-sars-cov-.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


