特应性皮炎新药!艾伯维口服JAK1抑制剂Rinvoq新适应症审查遭美国FDA推迟3个月!
来源:本站原创 2021-04-07 01:28
Rinvoq是一款口服JAK抑制剂,已被批准治疗类风湿性关节炎。

2021年04月06日讯 /生物谷BIOON/ --艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已延长了口服抗炎药Rinvoq(upadacitinib,15mg,每日一次)治疗中度至重度特应性皮炎(AD)成人患者和青少年患者的补充新药申请(sNDA)的审查期。最新的《处方药用户收费法》(PDUFA)目标行动日期已延长3个月,至2021年第三季度初
Rinvoq是一种口服、选择性、可逆性JAK抑制剂,在美国已被批准用于治疗类风湿性关节炎(RA)。如前所述,艾伯维收到了FDA关于更新Rinvoq治疗特应性皮炎(AD)的受益风险评估的信息请求。艾伯维回应了这一请求,FDA已经通知艾伯维,该机构将需要额外的时间对提交的文件进行全面审查。
值得一提的是,今年3月中旬,FDA也延长了Rinvoq治疗活动性银屑病关节炎(PsA)成人患者补充新药申请(sNDA)的审查期。最新的《处方药用户收费法》(PDUFA)目标行动日期已延长3个月,至2021年第二季度末。原因是与上述相同:艾伯维收到了FDA关于更新Rinvoq治疗银屑病关节炎(PsA)的受益风险评估的信息请求。艾伯维回应了这一请求,FDA将需要额外的时间对提交的文件进行全面审查。
艾伯维副主席兼总裁Michael Severino医学博士表示:“我们仍然对Rinvoq的sNDA充满信心,并致力于与FDA合作,为需要新治疗方案的中重度特应性皮炎和银屑病关节炎患者提供Rinvoq。”
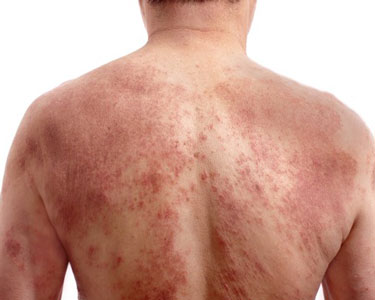
特应性皮炎(图片来源:icresearch.net)
特应性皮炎(AD)是一种常见的、慢性、复发性、发炎性皮肤病,表现为瘙痒和抓挠的反复循环,导致皮肤疼痛、破裂。据估计,多达25%的青少年和10%的成年人在一生中的某个时候会受到AD影响。20%-46%的成人AD患者会有中度至重度疾病。该病的疾病症状会对患者造成重大的生理、心理和经济负担。2020年10月,艾伯维同时向美国FDA和欧盟EMA提交了Rinvoq治疗特应性皮炎(AD)的新适应症申请。
Rinvoq治疗特应性皮炎的新适应症申请,基于3项关键3期临床研究的数据支持。在Measure Up 1和Measure Up 2研究中,Rinvoq没有与局部皮质类固醇激素(TCS)联合应用,在AD Up研究中Rinvoq与TCS联合用药。结果显示,在所有3项临床研究中,与安慰剂相比,Rinvoq治疗使中重度特应性皮炎成人和青少年患者的皮损清除率和瘙痒程度上都有显著改善。Rinvoq达到了共同主要终点,包括治疗第16周湿疹面积和严重程度指数(EASI)较基线至少改善75%(EASI 75)、特应性皮炎经验证的调查员总体评估(vIGA AD)评分为0/1(皮损清除或几乎完全清除)。另外,接受任何剂量Rinvoq治疗的患者中,有更高比例的患者瘙痒症状有临床意义的减轻,定义为最严重瘙痒数值评定量表(NRS)≥4。
在特应性皮炎的3项关键3期研究中,Rinvoq的安全性是一致的。在这些研究中,与接受Rinvoq治疗的类风湿关节炎、银屑病关节炎、强直性脊柱炎患者中观察到的安全性相比,Rinvoq治疗特应性皮炎没有发现新的安全风险。
Rinvoq的活性药物成分为upadacitinib,这是由艾伯维发现和开发的一种口服选择性和可逆的JAK1抑制剂,正被开发治疗数种免疫介导的炎症性疾病。JAK1是一种激酶,在多种炎症性疾病的病理生理过程中发挥了关键作用。
Rinvoq于2019年8月在美国获得全球首个监管批准,用于治疗对甲氨蝶呤(MTX)应答不足或不耐受的中度至重度活动性类风湿性关节炎(RA)成人患者。在欧盟,Rinvoq于2019年12月获批上市,目前已批准的适应症包括:(1)用于治疗对一种或多种疾病修饰抗风湿药物(DMARD)应答不足或不耐受的中度至重度RA成人患者;(2)用于治疗对一种或多种DMARD应答不足或不耐受的活动性PsA成人患者;(2)用于治疗对常规疗法应答不足的活动性强直性脊柱炎(AS)成人患者。
目前,Rinvoq治疗溃疡性结肠炎(UC)、类风湿性关节炎(RA)、银屑病关节炎(PsA)、中轴型脊柱关节炎(axSpA)、克罗恩病(CD)、特应性皮炎(AD)、巨细胞动脉炎(GCA)的III期临床研究正在进行中。
业界对Rinvoq的商业前景非常看好。瑞银集团分析师此前预测,Rinvoq与艾伯维的另一款单抗抗炎药Skyrizi,销售峰值将达到110亿美元。这2款新产品,将能够弥补艾伯维旗舰产品Humira(修美乐,阿达木单抗)遭遇生物仿制药冲击带来的销售损失。
Humira是全球第一个获批的抗肿瘤坏死因子α(TNF-α)药物,也是全球最畅销的抗炎药,2020年的全球销售额接近200亿美元(198.32亿美元)。在欧盟,已有多款阿达木单抗生物仿制药上市销售。而在美国市场,Humira将在2023年受到生物仿制药冲击。(生物谷Bioon.com)
原文出处:AbbVie Announces Extension of Review for Supplemental New Drug application of Upadacitinib for the Treatment of Moderate to Severe Atopic Dermatitis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


