大B细胞淋巴瘤(LBCL)新药!艾伯维CD3xCD20双特异性抗体epcoritamab获美国FDA优先审查!
来源:生物谷原创 2022-11-25 11:57
epcoritamab是一种在研的IgG1双特异性抗体,可同时结合T细胞上的CD3和恶性B细胞上的CD20。

图片来源:摄图网
2022年11月21日讯 /生物谷BIOON/ --艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已受理epcoritamab(DuoBody®-CD3xCD20)的生物制品许可申请(BLA)并进行优先审查:用于治疗接受过2线或多线系统治疗的复发/难治性(R/R)大B细胞淋巴瘤(LBCL)成人患者。
此外,欧洲药品管理局(EMA)最近也受理了epcoritamab的营销授权申请(MAA):用于治疗接受过2线或多线系统治疗的R/R弥漫性大B细胞淋巴瘤(DLBCL,LBCL的一种主要亚型)成人患者。
epcoritamab是一种皮下注射的CD3xCD20双特异性抗体,由艾伯维与Genmab共同开发。临床数据显示,在先前接受过至少2线抗淋巴瘤治疗(包括CAR-T细胞治疗)的复发/难治性LBCL患者中,epcoritamab显示出疗效和持久缓解。
如果获得批准,epcoritamab将成为第一种可用于治疗LBCL的皮下注射双特异性抗体。epcoritamab的监管申请基于先前公布的治疗复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)EPCORE NHL-1 2期临床试验大细胞淋巴瘤(LBCL)扩展队列的初步结果。
该研究队列包括157名复发/难治性LBCL患者,先前治疗的中位数为3线,总缓解率(ORR)为63%,完全缓解率(CR)为39%。基线特征包括:61%的患者对初始治疗无效,20%曾接受过自体干细胞移植(ASCT),39%接受过CAR-T细胞治疗(75%对CAR-T治疗无效)。
先前没有接受过CAR-T细胞治疗的患者中,ORR为69%、CR为42%;先前接受过CAR-T细胞治疗的患者中,ORR为54%、CR为34%。中位随访10.7个月,中位缓解持续时间(mDOR)估计为12个月;在达到CR的患者中,mDOR尚未达到,89%的患者在9个月时仍处于CR状态。
epcoritamab的安全性与先前的研究结果一致。大多数治疗期间不良事件(TEAE)发生在治疗的前12周,并已得到解决。任何级别的最常见TEAE((发生率≥15%))包括细胞因子释放综合征(CRS,49.7%)、发热(23.6%)、疲劳(22.9%)、中性粒细胞减少症(21.7%)、腹泻(20.4%)、注射部位反应(19.7%)、恶心(19.7%)和贫血(17.8%)。最常见的3级或4级TEAE(≥5%)包括中性粒细胞减少(14.6%)、贫血(10.2%)、中性粒细胞计数减少(6.4%)和血小板减少(5.7%)。观察到的3级CRS为2.5%。未观察到4/5级CRS。
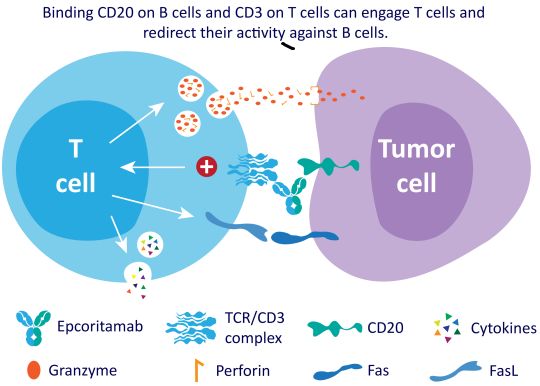
epcoritamab作用机制(图片来源:abbviescience.com)
LBCL是一种快速生长类型的非霍奇金淋巴瘤(NHL),LBCL主要亚型为DLBCL。NHL是一种在淋巴系统中发生并影响B细胞淋巴细胞(一种白血球)的癌症。LBCL是最常见类型的NHL,约占所有NHL病例的30%。据估计,全球每年约有150000例LBCL新病例。
epcoritamab是一种在研的IgG1双特异性抗体,使用Genmab专有的DuoBody技术创建。DuoBody-CD3技术旨在选择性地引导细胞毒性T细胞,以引发对靶细胞类型的免疫反应。epcoritamab能够同时结合T细胞上的CD3和B细胞上的CD20,并诱导T细胞介导的CD20阳性(CD20+)细胞的杀伤作用。
CD20在B细胞上表达,在许多B细胞恶性肿瘤中是一个经临床验证的治疗靶点,包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病(CLL)。
epcoritamab是艾伯维与Genmab广泛肿瘤学合作的一部分,由双方共同开发。双方将在美国和日本分担商业责任,艾伯维负责进一步的全球商业化。目前,双方正在评估epcoritamab作为单药疗法以及联合疗法,治疗一系列恶性血液肿瘤。其中包括:一项正在进行的3期开放标签随机临床试验(NCT04628494),评估epcoritamab作为单药疗法治疗复发/难治性DLBCL患者;另一项3期开放标签临床试验(NCT05409066),正在评估epcoridamab作为联合疗法治疗复发/难治疗性滤泡性淋巴瘤患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


