生物谷推荐: 8月必看的重磅级研究Top10!
来源:生物谷原创 2023-08-31 09:25
转眼间8月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习!
转眼间8月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习!
【1】PNAS:科学家发现一种新型的意想不到的癌细胞扩散机制
doi:10.1073/pnas.2303448120
癌细胞通常会受到内质网(ER, endoplasmic reticulum)的压力,为了获得生存优势,癌细胞就会利用未折叠蛋白反应的适应性方面,比如上调内质网管腔伴侣分子GRP78,当发生过表达时,GRP78就会逃逸到其它细胞区室中获得调节体内平衡和肿瘤发生的新功能,而这或许也代表了一种新的范式转变。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“ER chaperone GRP78/BiP translocates to the nucleus under stress and acts as a transcriptional regulator”的研究报告中,来自南加州大学等机构的科学家们通过研究揭示了癌细胞发生转移机制的关键细节,相关研究结果有望帮助开发新型治疗性手段来抑制癌细胞的扩散。
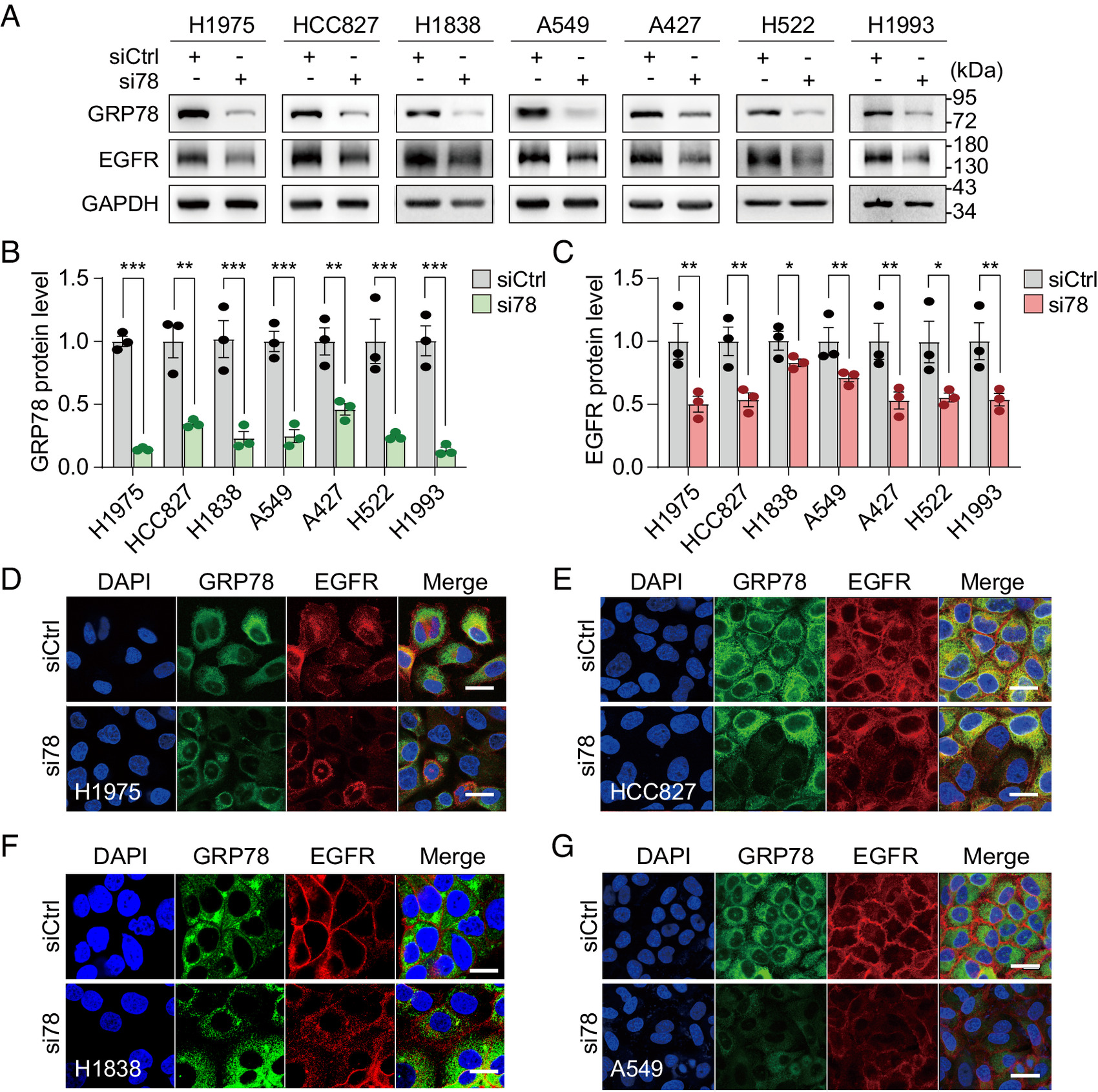
科学家发现一种新型的意想不到的癌细胞扩散机制。
图片来源:Proceedings of the National Academy of Sciences (2023). DOI:10.1073/pnas.2303448120
这项研究中,研究人员重点分析了一种名为GRP78的细胞伴侣蛋白,其能帮助调节细胞内其它蛋白质的折叠,此前研究结果表明,当细胞处于压力状态下时(比如COVID-19或癌症),GRP78就会被拦截,从而促使病毒入侵者进行复制,癌症生长以及对疗法耐受。如今研究者Lee及其同事取得了一项意外发现,这或许最终能帮助科学家们采取措施来保护细胞免于这种恶意的接管,通常情况下,GRP78位于细胞的内质网中,但当细胞处于压力状态下时,伴侣蛋白就会迁移到细胞核中,同时在那里其会改变基因的活性和细胞行为,并能促使癌细胞变得更具移动性和侵袭性。研究者Lee说道,在细胞核中观察GRP78控制基因的表达完全是一个惊喜,当谈及癌细胞的基本机制时,研究者表示,这是一个非常新的研究领域,此前并没有人观察过。本文研究结果或许代表了一种细胞生物学的范式转变,其对于癌症治疗研究具有非常重要的意义。
【2】Nat Immunol:震惊!T细胞在肿瘤暴露数小时内就出现功能衰竭
doi:10.1038/s41590-023-01578-y
在一项新的研究中,来自美国范德堡大学和威尔康乃尔医学院的研究人员发现免疫系统中本应能够杀死癌细胞的CD8+ T细胞在肿瘤暴露后数小时内就会出现功能障碍,即衰竭。这一惊人的发现对旨在利用T细胞杀伤肿瘤能力的癌症免疫疗法具有重要意义,同时也挑战了有关T细胞如何出现衰竭的现有观点。相关研究结果于2023年8月3日在线发表在Nature Immunology期刊上,论文标题为“Hallmarks of CD8+ T cell dysfunction are established within hours of tumor antigen encounter before cell division”。
研究者Mary Philip博士说道,人们一直认为,长期暴露于抗原(如肿瘤或病原体)的T细胞会不断地工作,然后在某一时刻逐渐衰竭。这就是衰竭一词的由来。我想没有人会想到,在6到12小时内,T细胞就会出现功能障碍或者说衰竭;这是一个非常快的时间窗口。为了探索T细胞是如何衰竭的,并确定可以预防或逆转T细胞衰竭的靶标,Philip和她的同事们使用了之前建立的遗传小鼠模型,在该模型中,小鼠随着年龄的增长,会以类似人类患者的方式患上肝脏肿瘤。他们可以跟踪肿瘤发展过程中的免疫反应,还可以引入可跟踪的T细胞,研究这些细胞如何对已形成的肿瘤做出反应。
Philip说,“对于被诊断出患有癌症的患者,我们无法回溯过去来了解免疫系统如何做出反应。这种小鼠模型让我们能够做到这一点,可以说,‘当T细胞第一次看到肿瘤时发生了什么;T细胞何时以及如何衰竭?在平行研究中,这些作者能够比较 T 细胞对肿瘤和感染的反应。Philip解释说,在急性感染的情况下,T细胞会发挥功能,而在肿瘤的情况下,T细胞会出现功能障碍。她说,“通过这种比较,我们可以比较‘好的’T细胞和功能失调的T细胞是什么样子。
【3】Science:科学家揭示肿瘤中基因表达的一种特殊协调机制
doi:10.1126/science.ade2292
肿瘤微环境(TMEs)影响着癌症的进展,而且其非常复杂且在不同患者之间存在一定的差异。近日,一篇发表在国际杂志Science上题为“CXCL9:SPP1 macrophage polarity identifies a network of cellular programs that control human cancers”的研究报告中,来自路德维希癌症研究中心等机构的科学家们通过研究识别出了一对基因,其在肿瘤内的一种免疫细胞中的表达或能帮助预测癌症患者的治疗结局,且与肿瘤微环境中多细胞类型参与的基因表达程序的庞大网络有关,这些基因表达程序网络能控制人类癌症的进展。
研究者认为,机体中肿瘤相关巨噬细胞中CXCL9基因高表达的患者要比机体中免疫细胞中SPP1基因高表达的患者的临床结局要好,表达前者基因的巨噬细胞总是能准备好攻击癌细胞,而能表达SPP1的巨噬细胞则处于支持肿瘤生长的状态;然而,有意思的是,当肿瘤微环境中CXCL9与SPP1的比率较高时,其它肿瘤微环境细胞中的基因表达程序则会显示出类似的抗肿瘤倾向,而从另一方面来讲,较低的CS比率(CXCL9与SPP1)总是伴随着整个肿瘤微环境的促肿瘤基因表达特征。
研究者Pittet说道,我们非常惊讶地发现,仅仅这一个参数(巨噬细胞主要表达的两个基因的比例)就能告诉我们关于肿瘤的很多其它信息,而对于多种类型的实体瘤而言也都是如此,这就意味着,尽管非常复杂,但肿瘤的微环境都是由一套明确的规则来控制着,而这项研究中研究人员就描述了其中的一种。研究者认为,随着前瞻性临床研究的进一步验证,CS比率可能是一种容易测定的知识患者预后的分子标志物,同时也能作为一种进行疗法管理的有用工具,本文研究所识别出的跨细胞类型的相关基因表达特征也能揭示用于开发新型药物的多个潜在的分子靶点,这些药物或许促使肿瘤微环境进入一种对于诸如免疫疗法等疗法非常易感的状态。
肿瘤微环境中的非癌变细胞在肿瘤的生长和生存过程中也发挥着重要作用,这些细胞包括能大量产生组织分子填料的成纤维细胞、构建血管的内皮细胞、排列在体腔的上皮细胞以及多种能帮助或阻碍肿瘤生长的免疫细胞种类;靶向作用这些细胞治疗癌症的可能性是非常诱人的,因为相比恶性细胞而言,这些细胞并不太会快速突变以及不太会进化对疗法耐受。研究者Pittet及其同时非常感兴趣研究不同肿瘤之间的肿瘤微环境到底有多少差异,为了找到答案,他们对来自51名头颈癌的52份原发和转移性肿瘤样本进行无偏见的分析,检查了单一细胞中所捕获的整体基因表达情况,并在整个肿瘤中进行了统计分析来研究其与患者结局是否相对应。
doi:10.1016/j.cell.2023.07.006
机体胃肠道和消化问题仅在美国就影响着大约300万人的健康,而且这一数字一直在增长,近日,一篇发表在国际杂志Cell上题为“PIEZO2 in somatosensory neurons controls gastrointestinal transit”的研究报告中,来自Scripps研究所等机构的科学家们通过研究揭示了感觉神经元是如何控制机体胃肠道的,相关的研究结果有望帮助我们重塑对机体相关疾病发生机制的理解。
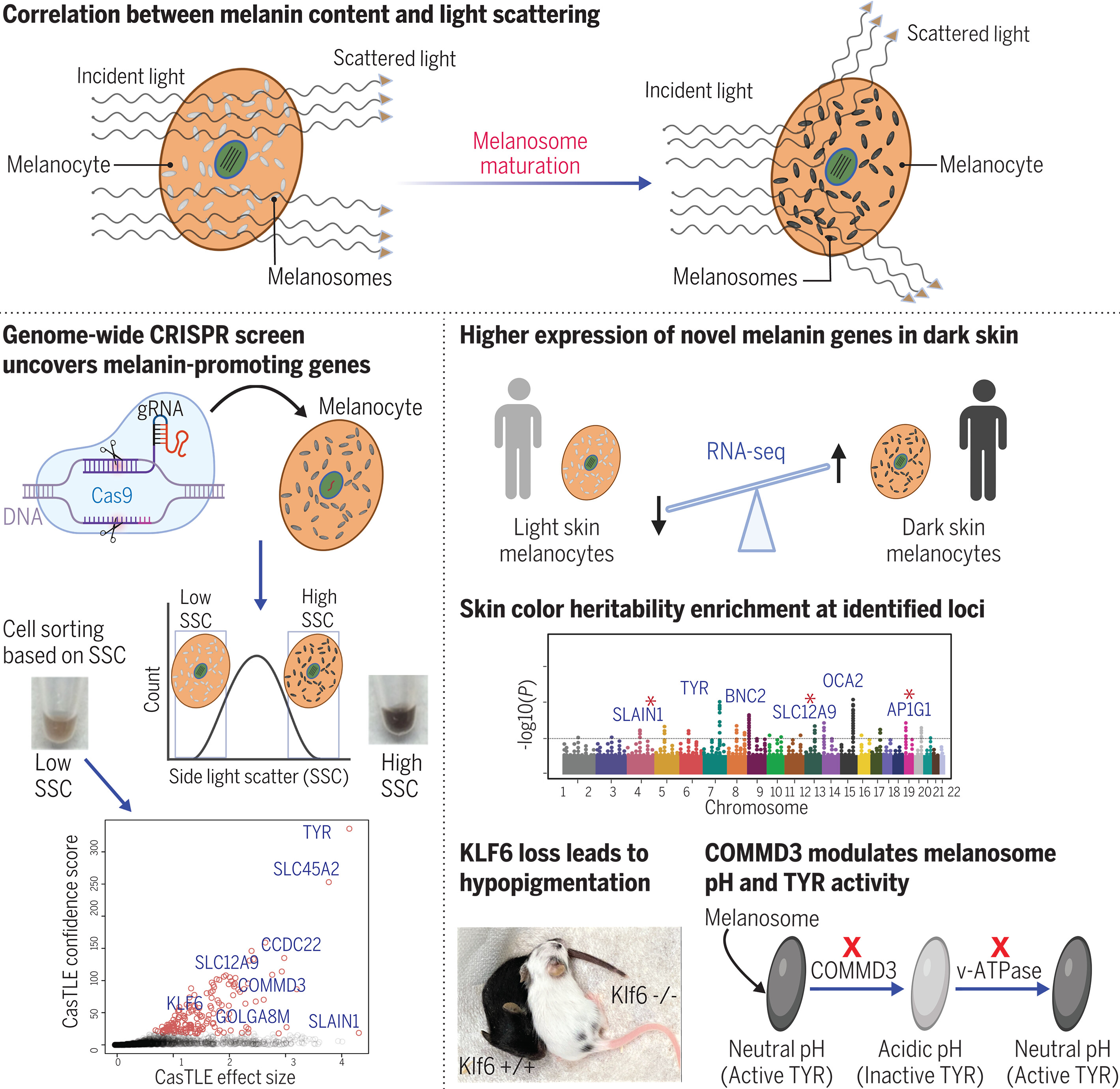
科学家识别出169个基因或与人类皮肤、头发和眼睛中黑色素的产生直接相关。
图片来源:Science (2023). DOI:10.1126/science.ade6289
文章中,研究人员利用人类临床数据和动物模型的组合进行研究揭示了,受体PIEZO2能通过感知食物存在和相应减缓肠道运动速度来控制胃部、小肠和结肠的胃肠道运输,这些研究发现有望帮助开发治疗一系列胃肠道疾病的新型疗法,包括炎性肠病和肠易激综合征等。Ardem Patapoutian教授说道,PIEZO2在胃肠道生理学机制中扮演着关键角色,同时其对于正常的肠道功能而言也是非常必要的,Ardem Patapoutian教授因发现PIEZO2及其相关受体PIEZO1对于细胞对机械刺激的反应非常重要而获得了2021年的诺贝尔生理学或医学奖,食物和其它所摄入的内容物都会激活PIEZO2,从而明显减缓肠道的肠道的运输。
肠道运输时间(食物通过胃肠道的速度)对于消化、营养的吸收和废弃物的排出都非常重要,最佳的消化需要最佳的运输时间,太慢机体会发生便秘,太快机体就会面临腹泻风险;截止到目前为止,科学家们对感觉通路是如何引导这一过程的理解非常有限。为此,这项研究中,研究人员决定调查是否来自PIEZO2受体的感觉输入在肠道的运动中扮演着重要角色,PIEZO2蛋白能被机械力或压力所激活,且在机体全身范围内都存在;尽管此前研究人员并未阐明其在胃肠道运动中所扮演的关键角色,但PIEZO2受体也参与到了感知肺部膨胀或膀胱充盈的程度,因此这些受体或许也能帮助检测胃肠道的扩张。
【5】Science:科学家识别出169个基因或与人类皮肤、头发和眼睛中黑色素的产生直接相关
doi:10.1126/science.ade6289
肤色是最多样化的人类特征之一,其是由黑色素的数量、类型和分布来决定的。近日,一篇发表在国际杂志Science上题为“A genome-wide genetic screen uncovers determinants of human pigmentation”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究将169个基因与皮肤、头发和眼睛中的黑色素的产生联系了起来,文章中,研究人员对细胞样本进行了流式细胞分析和全基因组CRISPR筛选。
此前研究结果表明,黑色素在体内的产生和分布与肤色、头发颜色和眼睛色素沉着有关,这些特征要比外表更加重要,比如拥有更多黑色素的皮肤能够更好地保护机体抵御紫外线的照射。这项研究中,研究人员指出,尽管他们识别出了很多基因与黑色素的产生有关,但还有更多的基因或许并未被识别出来。
于是研究人员开始努力区分高黑色素细胞和低黑色素细胞(即能制造黑色素的细胞),他们利用黑色素的反射光特性,将荧光对准实验室培养皿中的细胞对其进行分类,一旦确定了细胞的分类,研究人员就利用CRISPR-Cas9技术对其进行编辑,基因会被系统性地突变来关闭其表达,随后研究人员再对其进行检测来观察细胞持续产生黑色素的情况。
【6】Nature:肿瘤抑制子p53或在机体损伤后组织修复上扮演着重要角色
doi:10.1038/s41586-023-06253-8
肺癌是引起全球人群癌症死亡的主要原因,肿瘤抑制基因TP53的突变在50%的肺腺癌中会出现,且与患者较差的预后相关,但p53如何抑制肺腺癌的发生,至今依然是个谜。近日,一篇发表在国际杂志Nature上题为“p53 governs an AT1 differentiation programme in lung cancer suppression”的研究报告中,来自斯坦福大学等机构的科学家们通过对实验室小鼠进行研究发现,p53或能进化地促进机体损伤后的组织和细胞修复。这一惊讶的发现就好像是你知道你最喜欢的小演员实际上是一位仅会在周末偶尔表演一下的奥斯卡获奖导演。
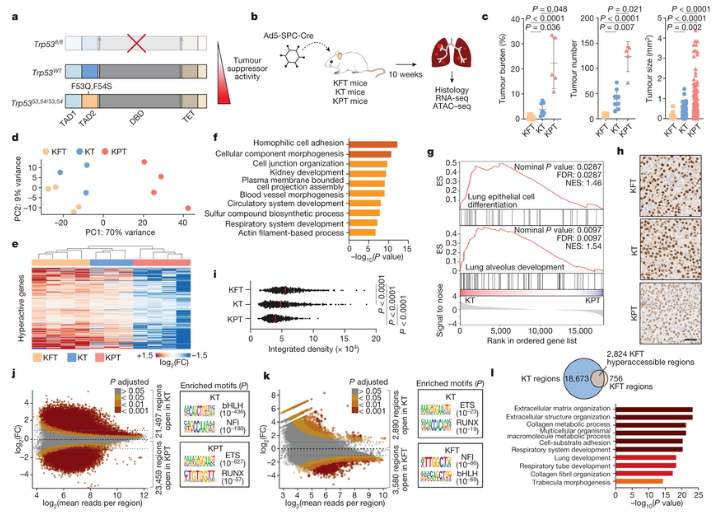
肿瘤抑制子p53或在机体损伤后组织修复上扮演着重要角色。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06253-8
Laura Attardi博士说道,这完全颠覆了我们对p53的认识,我们需要考虑p53作为肿瘤抑制子的作用或许是次要的,而其在修复组织损伤上的作用或许是最基本的。对p53在肺癌中的关键作用的研究表明,p53能调节一种肺部细胞过渡到另外一种肺部细胞,而这是在肺部组织受损时所发生的关键转变,如果没有p53的帮助,过渡的细胞就会陷入一种危险的中间阶段,从而摆脱正常生长的限制。就好像不守规矩的演员在绿色房子里等待永远不会到来的舞台一样,中间细胞就是研究人员所说的可塑性细胞,这意味着其会不受控制地进行分裂,承担新的细胞命运或角色,而这也是新生癌症的标志,这些细胞显然并不是好东西,但在癌症中其会促进肿瘤进展,而在其它疾病中则会促进组织损伤。
p53对于肺部损伤后的组织修复至关重要,这一发现让研究人员惊讶,因为这种蛋白质在癌症生物学中非常致命,而几十年来科学界将其称之为“基因组的守护者”,其能监测可能会导致致癌突变的DNA损伤,当感觉到麻烦时,其就会激活其它蛋白质来修复DNA,如果修复不成功的话,p53就会阻断细胞分裂并诱发细胞死亡。其在肿瘤抑制中的关键角色也反映在其是人类癌症中最常见的突变基因这一事实中,基于p53功能功能所开发的新型药物疗法目前并未获得成功。
doi:10.1073/pnas.2220269120
来自单一器官的血管内皮细胞在功能上都是专门的,其能表现出一套独特的可访问的分子靶点,这些靶点能充当内皮细胞亲和配体的受体,迄今为止,所有识别出的血管受体都是蛋白质。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Ceramide as an endothelial cell surface receptor and a lung-specific lipid vascular target for circulating ligands”的研究报告中,来自罗格斯大学医学院等机构的科学家们通过研究在肺部中发现了首个脂质血管“邮政编码”(ZIP code),将药物送到人体所需要的地方是成功治疗包括癌症在内的多种疾病以及避免毒性副作用的关键,但这对于科学家们而言仍然是一大挑战。
一种创新性的手段就是在机体的特殊位点识别出血管表面上存在的能扮演血管“邮政编码”的特殊蛋白受体,这些“邮政编码”能与诸如小型蛋白或抗体等配体进行物理性配对,从而就能用来引导并将“货物”(比如药物或诊断成像制剂)运输到特定的分子地址,其中一些配体-受体对已经在抗癌和抗肥胖药物的临床试验中进行了相关测试。
在这项研究之前,所有血管“邮政编码”都是蛋白质,这一研究发现揭示了血管中此前并未被识别的“邮政编码”脂质网络,也为改进多种人类严重呼吸道疾病患者的诊断和治疗方法提供了新的思路,这些疾病包括肺气肿、COVID-19、COPD和肺癌等。早在2008年,研究人员就发现了一种配体肽类,其能结合到肺部血管内皮细胞的表面,并能将细胞死亡通知信号直接运输到小鼠的肺部,然而,研究人员所使用的生化和遗传方法无法识别出配体结合的相应肺部血管“邮政编码”。
【8】Nat Genet:科学家有望识别出新型乳腺癌风险易感基因
doi:10.1038/s41588-023-01466-z
连锁和候选基因研究识别出了多个乳腺癌易感基因,但编码变异对乳腺癌发生的总体贡献,目前研究人员并不清楚。近日,一篇发表在国际杂志Nature Genetics上题为“Exome sequencing identifies breast cancer susceptibility genes and defines the contribution of coding variants to breast cancer risk”的研究报告中,来自拉瓦尔大学等机构的科学家们通过研究识别出了与乳腺癌发生相关的新基因,这些基因最终或许会被纳入到检测范围从而识别出乳腺癌风险增加的女性群体。
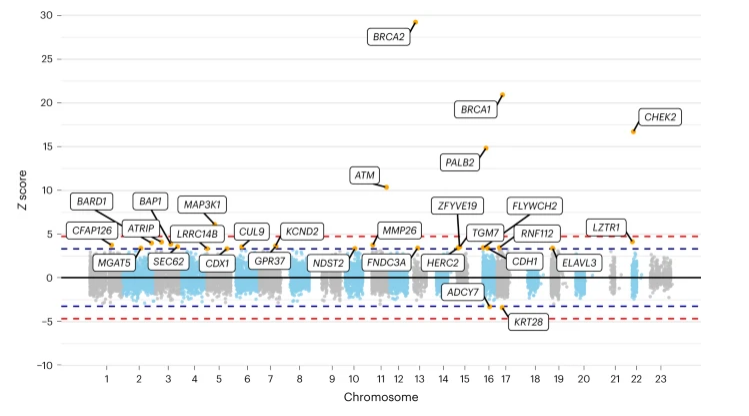
科学家有望识别出新型乳腺癌风险易感基因。
图片来源:Nature Genetics (2023). DOI:10.1038/s41588-023-01466-z
目前的乳腺癌基因检测仅考虑到了少数基因,比如BRCA1, BRCA2和PALB2基因,然而这些基因仅解释了遗传风险的一小部分,这或许就表示还有更多的基因有待于进一步鉴定。本文研究发现了至少有四个新型乳腺癌风险基因的相关证据,其它许多基因也有暗示性的证据,这些新基因的识别将有助于科学家们理解乳腺癌的遗传风险,而且这一新知识也将能通过识别出高风险的患病女性从而改善对乳腺癌风险的预测,也能为更好地进行乳腺癌筛查、降低风险和临床管理提供一定的信息。
研究者表示,这些新基因的发现也为癌症发生背后的生物学机制提供了重要的信息,有望帮助开发新型的治疗性策略。研究人员旨在将这些信息整合到目前全世界卫生专业人员所使用的综合性风险预测工具中,Jacques Simard教授说道,改善对高风险女性的遗传咨询或许能促进关于风险降低策略、筛查和确定治疗方案的共同决策。尽管这些新基因中所发现的大多数变异都是罕见的,但对于携带它们的女性而言或许风险是很大的,比如,新基因MAP3K1的改变似乎会导致个体患乳腺癌的风险增加。
【9】Science:科学家开发出了一种新型的KRAS解决策略 或有望克服“不可药用”的障碍
doi:10.1126/science.adj1001 doi:10.1126/science.adg9652
小分子抑制剂的发现需要再蛋白质表面有合适的结合袋,缺乏这一特征的蛋白质被认为是不可药用的,这就需要创新性的治疗性策略;KRAS是癌症中最为频繁的被激活的癌基因,而KRAS突变体的激活状态则是一个令人难以捉摸的靶标。近日,一篇发表在国际杂志Science上题为“Chemical remodeling of a cellular chaperone to target the active state of mutant KRAS”的研究报告中,来自纽约纪念斯隆凯特琳癌症研究中心等机构的科学家们通过研究开发了一种新方法,其或能绕过一种常见的致癌突变不可药用特质,这种致癌突变会驱动癌症发生以及对当前疗法的耐受性。
在这篇文章中,研究人员引入饿了一种能靶向作用活性突变KRAS的新方法,从而就有望解决“不可药用”的挑战(undruggable challenge);KRAS是一种臭名昭著的经常与多种癌症发生相关的细胞信号基因,其在驱动失控的细胞生长和增殖方面扮演着重要角色,KRAS突变存在于大约25%的肿瘤中,且是32%的肺癌、40%的结直肠癌和85%的胰腺癌病例背后的驱动突变,KRAS突变是人类机体中最常发生的致癌突变。
由于KRAS在多种人类癌症中扮演着重要角色,因此其也成为了治疗干预的主要目标,KRAS蛋白上缺乏合适的药物结合位点会成为开发有效药物疗法的重大障碍,从而就导致其被贴上了“不可药用”的标签,在现代科学中,诸如“不可药用”、“无法治疗”和“原因不明”等标签的保质期越来越短。
【10】JEM:溶瘤病毒或能促使“冷”肿瘤升温并改善免疫疗法治疗癌症患者的效率
doi:10.1084/jem.20230053
尽管检查点阻滞疗法已经取得了广泛的成功,但其依赖于反应性的免疫浸润,因此,目前研究人员也非常迫切需要开发出增强免疫浸润并预防免疫抑制的疗法。近日,一篇发表在国际杂志Journal of Experimental Medicine上题为“An oncolytic virus–delivered TGFβ inhibitor overcomes the immunosuppressive tumor microenvironment”的研究报告中,来自匹兹堡大学等机构的科学家们通过研究发现,给感染癌症的病毒(溶瘤病毒)装配上肿瘤抑制遗传载体或能刺激机体的免疫系统,并帮助免疫疗法缩小或完全消除小鼠体内的侵袭性肿瘤,相关研究结果或为将溶瘤病毒与免疫疗法相结合的临床试验铺平道路。
溶瘤病毒是一种遗传修改的病毒,其能靶向作用快速分裂的肿瘤细胞且能避免损伤正常的细胞,最初设计溶瘤病毒的目的就是直接杀伤癌细胞,但后来研究人员注意到其也能刺激机体的免疫系统,这或许就表明,溶瘤病毒能与诸如免疫检查点抑制剂等其它癌症疗法相结合进行使用,免疫检查点抑制剂能移除对免疫系统的“制动”以便T细胞能识别并攻击肿瘤。Greg Delgoffe博士说道,免疫检查点抑制剂仅能在“热”肿瘤中发挥作用,这些肿瘤能已经被T细胞所浸润,溶瘤病毒能帮助“冷”肿瘤升温,因此其或许能协同免疫疗法发挥作用,但目前研究人员尚未实现这一目标。
目前的问题在于,很多患者机体的肿瘤都无法对溶瘤病毒产生反应,研究人员对基于实验室的溶瘤病毒研究非常感兴趣,但目前尚未转化到临床中,而且他们还想通过研究理解肿瘤对这些病毒耐受背后的机制,从而观察应该如何做才能帮助患者。文章中,研究人员首先开发出了对名为牛痘苗(vaccinia)的溶瘤病毒非常敏感的头颈癌鳞状细胞癌(HNSCC)细胞系,当注射一剂病毒后肿瘤就会消退,同时研究人员还开发了第二种癌细胞系,其在其它方面完全相同但对牛痘苗会产生耐受性。当将这两种细胞注射到小鼠体内并比较肿瘤生长时机体的免疫学差异后,研究人员发现,对牛痘苗的耐受性或许是由高水平的信号蛋白TGF-β所驱动的,TGF-β被认为会通过抑制机体的免疫环境来促进癌症的生长。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


