11月Nature杂志重磅级亮点研究成果解读!
来源:生物谷原创 2025-11-28 09:38
时光总是在不经意间匆匆流过,转眼间11月份即将结束,在即将过去的11月里,Nature杂志又有哪些亮点研究值得一读呢?小编对相关亮点文章进行了筛选整理,分享给大家!
【1】Nature:大脑“GPS”升级版!科学家绘制出发育与炎症的立体地图
doi:10.1038/s41586-025-09663-y
大脑,堪称人体最复杂的器官,从出生到成熟,其如何一步步构建起精密的结构?当遭遇炎症攻击时,其又如何调度资源、启动修复?这些问题困扰了科学家几个世纪。如今,一篇发表在国际杂志Nature上题为“Spatial dynamics of brain development and neuroinflammation”的研究报告中,来自卡罗林斯卡学院等机构的科学家们利用自主研发的“空间三组学”技术,首次绘制出小鼠大脑从出生到发育成熟的全景多维地图,并揭示了大脑在应对炎症时竟会“重启”发育时期的程序。这项发现不仅刷新了我们对大脑运作的认知,更为多发性硬化等神经疾病的理解带来了全新视角。
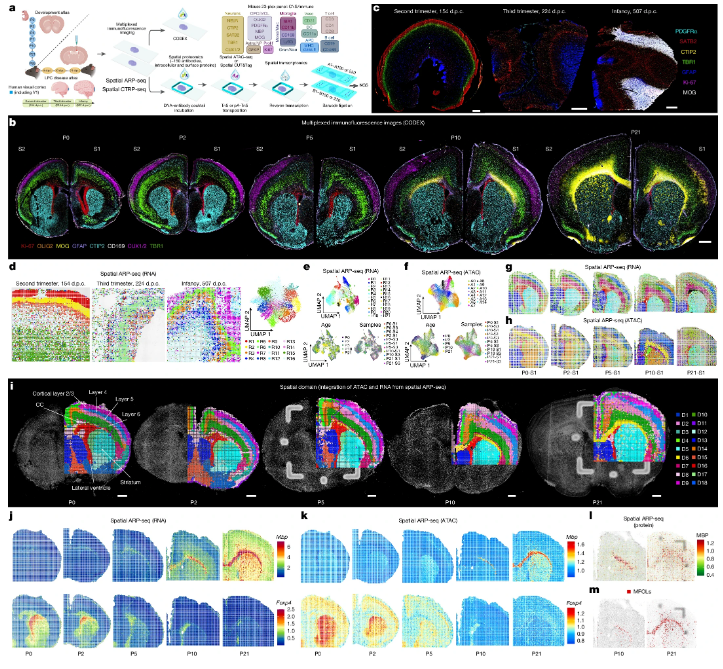
小鼠与人类大脑在髓鞘形成起始阶段的空间三组学图谱
想象一下,如果我们不仅能看清大脑的解剖结构,还能在同一时间、同一位置读取它的基因活动、表观调控和蛋白质表达,那将是一张何等精细的“大脑动态施工图”?这正是“空间三组学”的厉害之处,它能同时捕捉:1)基因活动(转录组);2)表观调控(染色质可及性);3)蛋白质表达(蛋白质组)。
Goncalo Castelo-Branco教授解释道,我们能用这种多维方法追踪大脑随时间发展的过程,绘制从出生到幼年不同脑区的变化,并研究大脑如何应对炎症。
【2】Nature:大脑“守护神”细胞被发现!阿尔茨海默病治疗迎来新曙光
doi:10.1038/s41586-025-09662-z
目前,全球有超过 5500 万人患有痴呆症,其中阿尔茨海默病(AD)是最常见的类型,随着人口老龄化加剧,这个数字预计在 2050 年将激增至 1.39 亿。尽管数十年来科学家们不懈探索,阿尔茨海默病的治疗依然举步维艰,传统靶向淀粉样蛋白斑块的疗法屡屡受挫。
近年来,研究焦点逐渐从斑块本身转向了大脑中的常驻免疫细胞——小胶质细胞,这些细胞本是大脑的 “守护者”,负责清除病原体和细胞碎片,但在阿尔茨海默病中,它们却会分化出两种极端状态:一部分变得亢进,释放大量炎症因子损伤神经元;另一部分则保持冷静,甚至主动抑制炎症。有没有可能,唤醒小胶质细胞的 “保护本能”,让它们从内部分化从而阻止疾病恶化?
近日,美国西奈山伊坎医学院、德国马克斯普朗克衰老生物学研究所等机构的科学家们在Nature发表重磅研究,给出了肯定答案。文章中,研究人员通过分析阿尔茨海默病小鼠模型、人类细胞及脑组织样本,发现了一群特殊的保护性小胶质细胞。这群细胞的标志是:1)低表达转录因子PU.1;2)高表达淋巴样受体CD28。尽管这群细胞在斑块周围只占少数,却能发挥“四两拨千斤”的作用,显著抑制神经炎症且能减缓淀粉样斑块积累和tau蛋白扩散。
doi:10.1038/s41586-025-09709-1
在全球范围内,黑色素瘤是恶性程度最高、转移能力最强的皮肤癌之一。据统计,晚期黑色素瘤患者的五年生存率仅为25%–30%,更可怕的是,其偏爱“兵分两路”,一路通过血液远走他乡,另一路则潜伏在淋巴结中,伺机而动。长期以来,科学家们一直在寻找能精准清除这些“潜伏者”的方法。
而最近,一篇发表在国际杂志Nature上题为“Lymph node environment drives FSP1 targetability in metastasizing melanoma”的研究报告中,来自哈佛大学陈曾熙公共卫生学院等机构的科学家们通过研究揭示了一个令人惊喜的发现:转移到淋巴结的黑色素瘤细胞竟然依赖一种名为 FSP1的蛋白质来“续命”;更关键的是,他们已经找到了能阻断它的药物,为阻止癌症扩散带来了全新希望。
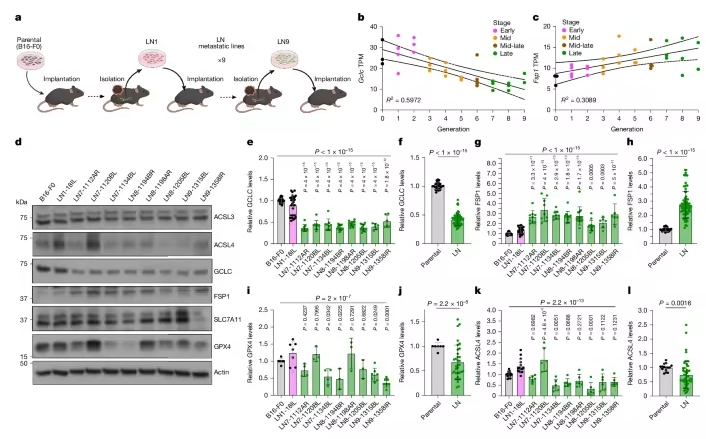
淋巴结转移细胞系呈现出FSP1表达升高,而GCLC、GPX4和ACSL4表达降低的特征
如果把细胞比作一台精密机器,那细胞膜就像机器的外壳,当这台机器“生锈”,也就是细胞膜上的脂质被过度氧化时,细胞就会崩溃死亡;这个过程就是“铁死亡”。有趣的是,癌细胞虽然疯狂增殖,却也害怕这种“生锈式自杀”,为此,它们准备了多套“防锈系统”,其中最重要的两套,分别由GPX4和FSP1这两个蛋白质掌控。
为什么癌细胞在淋巴结中特别依赖FSP1?研究人员发现,淋巴结这个“微环境”有两个特点:1)缺氧:淋巴结中氧气浓度较低,导致GPX4蛋白不稳定,容易被降解;2)代谢重塑:癌细胞在淋巴结中减少了抗氧化物质谷胱甘肽的合成,转而依赖FSP1来抵抗铁死亡。换句话说,淋巴结就像是一个“特训营”,逼着癌细胞换了一套保命机制,从依赖GPX4转向依赖FSP1。
【4】Nature 重磅突破!铁死亡疗法让癌细胞“引火自焚”,耐药难题迎转机
doi:10.1038/s41586-025-09710-8
肺癌常年稳居全球癌症死亡率榜首,其中,肺腺癌作为非吸烟者中最常见的肺癌类型,约占全部病例的40%。尽管靶向治疗和免疫疗法不断进步,但耐药和复发仍是悬在患者头上的“一把剑”,传统疗法难以攻克的顽固肿瘤,有没有可能被 “诱导自杀”?近年来,一个名为“铁死亡”的概念在癌症研究领域悄然走红,这是一种由铁依赖的脂质过氧化驱动的细胞死亡方式,犹如在细胞内部点燃一场“氧化火灾”;而癌细胞为了活命也进化出了一套“灭火系统”。如今,科学家们正试图拆掉这个系统让癌细胞“引火自焚”。
一篇发表在国际杂志Nature上题为“Thales Papagiannakopoulos,Targeting FSP1 triggers ferroptosis in lung cancer”的研究报告中,来自纽约大学Grossman医学院等机构的科学家们通过研究发现,一种实验性药物或能阻断关键蛋白的功能从而诱发肺癌细胞自杀。
铁死亡,顾名思义,是一种与铁密切相关的细胞死亡方式,当细胞内的铁离子积累过多就会催化脂质发生过氧化反应并产生大量活性氧,最终导致细胞膜破裂、细胞崩溃。这本是机体清除异常细胞的天然机制,但狡猾的癌细胞却发展出两套关键的“防火墙”: GPX4和FSP1。
【5】Nature:给乳房“减压”,这款老药或成防癌新利器!
doi:10.1038/s41586-025-09684-7
乳腺癌是全球女性中最常见、也是最致命的癌症之一。据统计,每年有超过200万女性被诊断出乳腺癌,其中约十分之一在确诊时已处于晚期;尤其令人担忧的是,在年轻女性和黑人女性群体中,一种名为“三阴性乳腺癌”的亚型更为常见,其侵袭性强、复发率高,治疗难度大。那么有没有可能,在癌症尚未形成之前就“掐断”其萌芽之路呢?近日,一篇发表在国际杂志Nature上题为“Anti-progestin therapy targets hallmarks of breast cancer risk”的研究报告中,来自英国曼彻斯特大学等机构的科学家们通过研究给出了一个令人振奋的答案,一款已上市的药物或能成为预防乳腺癌的“新武器”。
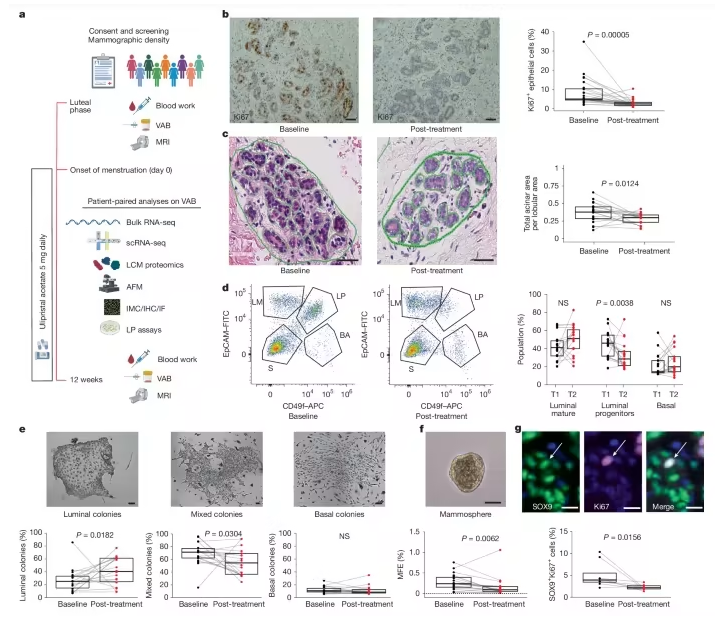
抗孕激素治疗可降低管腔祖细胞的活性
我们都知道,激素在乳腺癌发生中扮演关键角色,除了雌激素,孕激素同样是一个“潜伏高手”,其不仅会促进某些乳腺细胞的生长,还可能改变乳腺内部的环境,让正常细胞更容易“叛变”成癌细胞。这项研究中,科学家们把目光投向了醋酸乌利司他(Ulipristal acetate),其一种已在临床上用于其他妇科疾病的药物,那么其能否通过阻断孕激素的作用,降低高风险女性的乳腺癌发生率呢?
在2016至2019年间,研究人员招募了24名年龄在34至44岁、有乳腺癌家族史的绝经前女性参与了名为“BC-APPS1”的临床试验,她们接受了为期12周的乌利司他治疗,并在治疗前后分别进行了乳腺活检、血液检测和磁共振成像扫描。研究人员采用了一种“多维度”的分析策略,即从影像学到单细胞RNA测序,从蛋白质组学到原子力显微镜,他们试图从不同层面回答一个问题:这款药物是否改变了乳腺组织的“癌变土壤”?
【6】Nature:基因“寻宝图”出新版!两种方法合体,疾病根源无处遁形
doi:10.1038/s41586-025-09703-7
想象一下,你手上有两张藏宝图,一张标注了100个可能的藏宝点,另一张只标了3个,你会相信哪一张?在遗传学领域,科学家们正面临同样的“选择困难”,全球有超过4亿人受罕见病和复杂疾病困扰,而中国出生缺陷总发生率约5.6%,其中遗传因素贡献显著。为了找到致病的“罪魁祸首”,研究人员最常使用两种“寻宝图”:全基因组关联分析(GWAS)和罕见变异负荷检验。
问题是,这两张“地图”指出的方向常常不一致。近日,一篇发表在国际杂志Nature上题为“Specificity, length and luck drive gene rankings in association studies”的研究报告中,来自斯坦福大学等机构的科学家们通过研究终于揭开了谜底:原来它们本就不是竞争对手,而是最佳拍档。
文章中,研究人员对英国生物样本库中209种人类性状的基因数据进行了系统性对比,结果发现,GWAS像是一台“广角镜头”,能捕捉到与疾病相关的数百个基因,但其中不少是“多面手”,同时影响多种性状;而负荷检验则像“长焦镜头”,更擅长锁定那些对特定疾病“情有独钟”的基因。这就像用不同的滤镜看同一片星空,GWAS能看到所有亮星,而负荷检验只聚焦那些特定颜色的恒星。
【7】Nature:大脑“高清地图”问世!AI带你看清脑海的每一寸风景
doi:10.1038/s41586-025-09708-2
想象一下,你手头有一张世界地图,却只能看到国家边界而无法分辨城市、街道、甚至你家门口的那棵老树;对于神经科学家们而言,过去几十年里,人类大脑的图像就处于这样的“像素危机”中。据统计,全球有超过5500万人受阿尔茨海默病等痴呆症影响,而中国60岁及以上人群中痴呆患者约1500万,随着人口老龄化加剧,这一数字预计将持续攀升。要理解这些疾病如何侵蚀我们的大脑,仅知道“海马体萎缩”远远不够,我们更需要看清它的每一个角落、每一条“街巷”。
近日,一篇发表在国际杂志Nature上题为“A probabilistic histological atlas of the human brain for MRI segmentation”的研究报告中,来自伦敦大学学院等机构的科学家们通过利用AI技术成功构建出了全球首个全脑概率性组织学图谱—NextBrain,这项历时六年的工程不仅将大脑图像的精度推向了前所未有的高度,更让科学家能在几分钟内就能从活人的MRI扫描中识别出333个大脑区域,甚至包括海马体中那些微小的“子街区”。
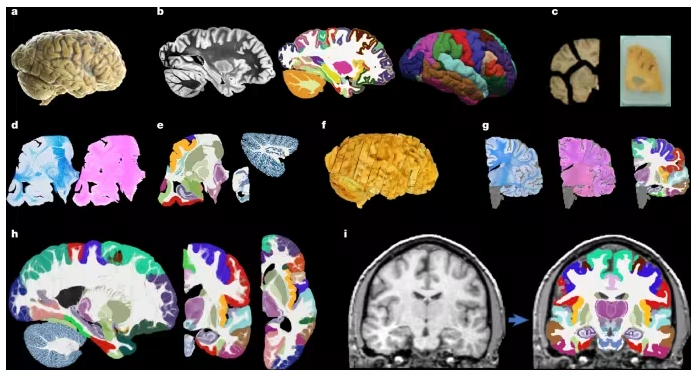
NextBrain的工作流程
研究者表示,如果说传统脑图谱是城市交通图,那NextBrain就是实景三维导航;他们不仅能看到“海马区”,还能看清它内部的每一条“小巷”以及这些小巷在不同疾病中是如何变化的。
【8】破解基因“缺失密码”!Nature:35 万人基因组揭示 88% 遗传力,罕见变异+非编码区才是易胖、高血压的关键
doi:10.1038/s41586-025-09720-6
你是否曾疑惑,为什么有人怎么吃都不胖,有人喝凉水都长肉?为什么有人身高直奔一米九,有人却总得仰视他人?这背后究竟是基因的“暗中操控”,还是后天环境的“潜移默化”? 随着精准医学和基因测序技术的飞速发展,我们正逐渐揭开遗传因素对人类健康与特征的深层影响。据统计,全球有超过4亿人患有糖尿病,近20亿成年人超重或肥胖,心血管疾病更是常年位居死因榜首,这些常见病与复杂性状到底有多少是“命中注定”?
最近,一篇发表在国际杂志Nature上题为“Estimation and mapping of the missing heritability of human phenotypes”的研究报告中,来自澳大利亚昆士兰大学等机构的科学家们通过进行一项大型基因组研究,或许给出了迄今为止最接近真相的答案。
这项研究中,研究人员分析了英国生物样本库中34.7万欧洲裔人群的全基因组数据,系统评估了34种复杂性状与疾病的遗传贡献度,包括身高、体重、胆固醇、高血压、生育力、吸烟行为、心脏病等。相关研究不仅证实了基因对个体差异的重要影响,还首次实现了对罕见非编码变异的系统性评估,这是传统研究方法难以触及的“遗传暗物质”。
【9】Nature 重磅:3 个罕见基因变异让多动症风险飙升 15 倍!智商、学历都受终身影响
doi:10.1038/s41586-025-09702-8
你是否曾因孩子坐不住、注意力不集中而焦虑?是否觉得 “多动” 只是调皮,或是教养方式的问题?事实上,注意缺陷多动障碍(ADHD)是一种真实且常见的神经发育疾病——全球约 5% 的儿童和 2.5% 的成人受其困扰,它不仅会影响学习与工作效率,更与物质滥用、意外事故、失业、犯罪甚至过早死亡等严重后果密切相关。
过去,ADHD 常被归因于环境或教养因素,但科学早已证实,遗传是核心驱动力(双生子研究显示遗传力达 77%-88%)。而近日发表在Nature上的一项重磅研究,首次揭开了 “罕见基因变异” 在 ADHD 中的关键作用,为我们理解这种疾病提供了全新视角。
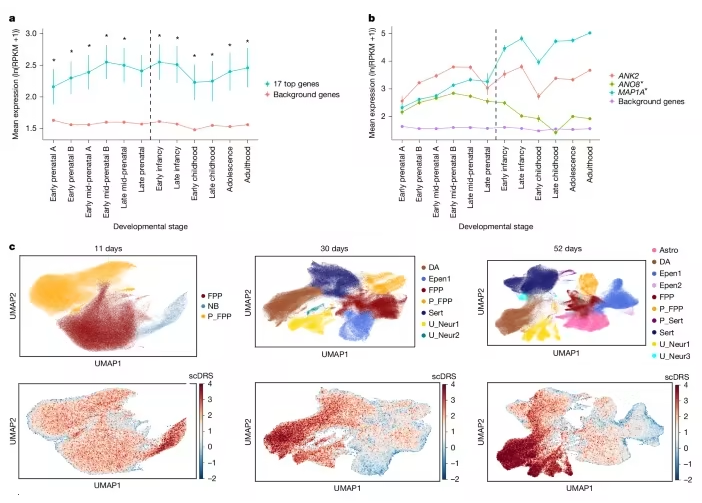
ADHD风险基因在不同大脑发育阶段及细胞类型中的表达情况
这篇题为 “Rare genetic variants confer a high risk of ADHD and implicate neuronal biology” 的研究,由丹麦奥胡斯大学、美国博德研究所等机构联合完成,通过大规模外显子测序,系统性分析了罕见变异对 ADHD 的影响。研究团队纳入了 8895 名 ADHD 患者和 53780 名健康对照(数据来自丹麦 iPSYCH 队列和国际 gnomAD 数据库),结合蛋白质互作网络分析、单细胞 RNA 测序等技术,不仅找到了高风险基因,还揭示了这些变异如何从分子层面影响大脑发育,进而改变患者的人生轨迹。
【10】贴一贴就控糖!Nature:浙大新型“智能聚合物”穿透皮肤送胰岛素,告别针头不是梦
doi:10.1038/s41586-025-09729-x
糖尿病,早已不是陌生的名词。据国际糖尿病联盟(IDF)统计,全球有超过 5 亿成年人患有糖尿病,预计到 2045 年将突破 7 亿;中国更是 “糖尿病大国”,患者人数高达 1.4 亿,相当于每 10 个成年人中就有一人患病。对许多患者来说,每天数次皮下注射胰岛素不仅是身体上的负担,更是心理上的折磨 —— 针头恐惧、皮肤硬结、出行携带不便等问题,严重影响生活质量。那么,有没有一种方式能让他们摆脱针头的困扰,轻松控糖呢?
日前,一篇发表在国际顶刊Nature上题为 “A skin-permeable polymer for non-invasive transdermal insulin delivery” 的研究报告中,来自浙江大学等机构的科学家们给出了突破性答案:一种名为 OP(聚 [2-(N-氧化物-N,N-二甲氨基) 乙基甲基丙烯酸酯])的新型智能聚合物,能像 “护送队” 一样携带胰岛素穿透皮肤直达血液,让控糖变得像贴创可贴一样简单无痛。
我们平时用的退烧贴、激素贴都属于 “透皮给药”,这种方式方便、无创,患者依从性高。但皮肤是身体的 “天然盔甲”,尤其是最外层的角质层,由紧密排列的死细胞和脂质构成,像一道坚固的城墙,只允许个头小(通常小于 500 道尔顿)、脂溶性好的小分子药物通过。而胰岛素是分子量约 5.8 kDa 的蛋白质 “大块头”,皮肤对其几乎 “完全封锁”。
过去几十年,科学家尝试过微针、超声波、化学促渗剂等方法,但要么会破坏皮肤结构带来感染、刺激风险,要么递送效率太低,难以在临床上推广。人们一直渴望找到一种能 “温和穿越” 皮肤屏障,又不损伤组织的 “药物运输车”。
【11】Nature:一“编”永逸?新型基因编辑疗法有望通治多种遗传病!
doi:10.1038/s41586-025-09732-2
当我们谈论遗传病时,常常会觉得它们“罕见”,但若将全球已知的7000多种罕见病患者加起来,总数已超过3亿—这绝非一个小数目;其中,约80%的罕见病由基因突变引起,长期以来,“一种病,一种药”是基因治疗难以逾越的困局,研发周期长、成本高昂使得绝大多数罕见病药物望而却步,无数患者家庭在等待中煎熬。
但现在,转机或许已经出现。一篇发表在国际杂志Nature上题为“Prime editing-installed suppressor tRNAs for disease-agnostic genome editing”的研究报告中,来自哈佛大学博德研究所等机构的科学家们通过研究开发出了一种名为 PERT(prime editing-mediated readthrough of premature termination codons,引导编辑介导的提前终止密码子通读技术)的新型基因编辑策略,其有望用“一种疗法”治疗多种不同的遗传病。
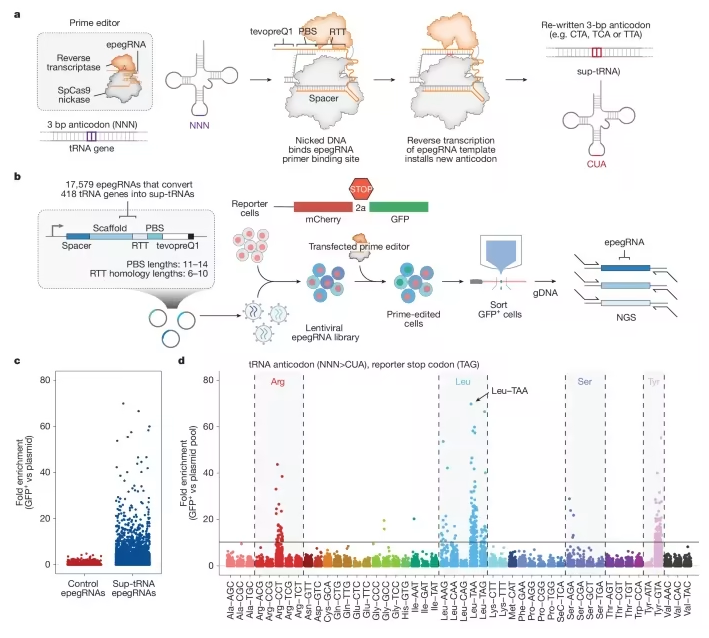
引导编辑介导的哺乳动物细胞内核源性tRNA向抑制性tRNA的转化
近年来,以碱基编辑和引导编辑为代表的精准基因编辑技术能修正大多数致病基因变异,但问题在于,每个突变都需要开发一套新的治疗试剂,这就像为每扇坏掉的门定制一把不同的钥匙,虽然精准却难以规模化。有没有可能打造一把“万能钥匙”,同时打开多扇门?这项研究中,研究人员把目光投向了遗传病中一个非常常见的“破坏分子”—无义突变。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


