慢性自发性荨麻疹(CSU)新药!诺华新一代IgE抗体ligelizumab 3期临床:疗效未超越Xolair(奥马珠单抗)!
来源:本站原创 2021-12-21 14:46
在2项3期研究中,ligelizumab疗效优于安慰剂,但与Xolair(奥马珠单抗)相比未显示出优越性。
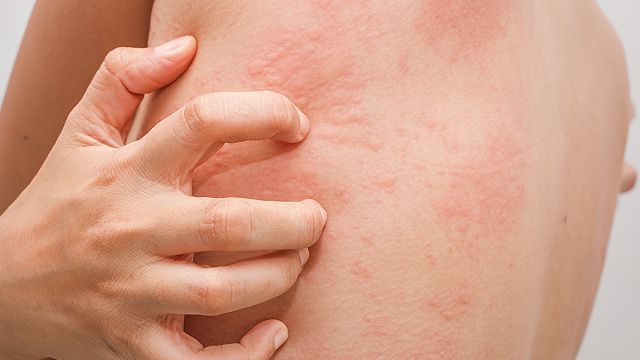
CSU(图片来源:rappler.com)
2021年12月20日讯 /生物谷BIOON/ --诺华(Novartis)近日公布了2项3期研究(PEARL 1和PEARL 2)的顶线结果。这2项研究是设计相同的多中心、 随机、双盲、阳性药物和安慰剂对照、平行组研究,在超过2000例对H1抗组胺治疗应答不足的慢性自发性荨麻疹(CSU)成人和青少年(≥12岁)患者中开展,评估了单抗药物ligelizumab(QGE031)相对于安慰剂、Xolair(omalizumab,奥马珠单抗)的疗效和安全性。
2项研究中,患者被随机分配,接受ligelizumab 72mg、ligelizumab 120mg、Xolair 300mg、安慰剂治疗,每4周一次,治疗一年。最初随机分配至安慰剂的患者,从第24周开始转向ligelizumab 120mg治疗,直至52周治疗期结束。主要终点是治疗第12周7日荨麻疹活动度评分(UAS7)相对于基线的变化。
结果显示,在2项研究中:治疗第12周,ligelizumab与安慰剂相比在主要终点方面显示出优越性,但与Xoliris相比没有显示出优越性。
诺华制药全球药物开发负责人兼首席医疗官John Tsai医学博士表示:“我们很失望,我们无法证明ligelizumab在治疗CSU方面优于标准治疗。我们将继续评估ligelizumab在慢性诱导性荨麻疹(CIndU)和食物过敏领域为患者带来益处的潜力,这些领域存在大量未满足的需求。”
在2022年下半年研究完成后,诺华将公布2项研究的完整数据。最近,诺华启动了remibrutinib(LOU064)的3期研究,该药是一种高选择性、强效、口服BTK抑制剂,此前已显示出快速有效的CSU疾病控制。
CSU也被称为慢性特发性荨麻疹(CIU),这是一种不可预测的严重皮肤疾病,其典型表现为在无特定外部刺激的情况下出现荨麻疹(瘙痒、疼痛的风团)、肿胀(血管性水肿)或两者兼而有之。由于严重性和不可预测性,CSU对患者可能具有挑战性或令人沮丧。该病通常持续1-5年,但在某些患者中持续更久,会对生活质量产生负面影响。CSU的发病机制尚未完全明确,但目前已知大多数患者均涉及自身免疫机制。
CSU影响约1%的人群,大约60%的患者在一线抗组胺治疗中未达到完全控制病情。当前,CSU采用第二代抗组胺药物治疗,大剂量抗组胺药治疗失败时,通常加用(add-on)抗IgE单克隆抗体Xolair(奥马珠单抗)作为三线疗法,即便如此许多患者仍无法完全控制症状。
Xolair由诺华与罗氏旗下基因泰克合作开发和推广,这是一种靶向结合IgE的单克隆抗体药物,通过皮下注射给药,该药于2003年首次获批,用于治疗症状难以控制的哮喘患者,2014年再次获批用于对H1抗组胺药物难治的慢性荨麻疹(CSU)。在美国和欧洲,Xolair已失去专利保护,目前诺华正在积极推动ligelizumab的临床开发。
ligelizumab作用机制(点击图片查看大图)
ligelizumab是新一代人源化抗IgE单克隆抗体,可阻断IgE/FceR1信号通路,该通路是CSU炎症过程的关键驱动因素。ligelizumab具有高于Xolair的IgE亲和力,目前处于III期临床开发,用于治疗接受H1抗组胺药物治疗无法充分症状的CSU患者。该药III期项目包括2项III期临床研究(PEARL 1,PEARL 2),在全球48个国家招募了2000多例患者。
2021年1月,美国FDA授予了ligelizumab突破性药物资格,用于治疗对H1抗组胺治疗应答不足的慢性自发性荨麻疹(CSU)患者。值得一提的是,ligelizumab是第一个获FDA授予BTD治疗H1抗组胺药物应答不足CSU患者的药物。目前,对CSU患者的治疗方法有限。BTD资格认定,表明ligelizumab有潜力提供超过现有疗法的实质性益处。
在IIb期剂量发现试验中,与Xolair治疗组相比,ligelizumab治疗组有更高比例的患者实现风团(麻疹)完全缓解。在抗组胺药控制不佳的CSU患者中,与Xolair或安慰剂相比,ligelizumab没有发现安全问题。
诺华此前计划,将在2022年向美国FDA提交ligelizumab的上市申请。作为Xolair的后继产品,如果ligelizumab成功上市,将帮助诺华捍卫CSU治疗领域的专营权。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



