深度剖析!机体微生物组影响多种药物作用的分子机制!
来源:本站原创 2019-07-24 13:32
2019年7月24日 讯 /生物谷BIOON/ --在美国,每年有超过1万人被诊断为皮肤癌,转移性黑色素瘤则是一种非常严重的疾病,这种癌症通常从皮肤开始发生,一旦扩散到机体的淋巴结和内脏中时,通常患者几乎没有任何生存机会,然而最近获批的几种检查点抑制剂和BRAF抑制剂药物在一些患者身上出现了戏剧性的反应,患者机体的肿瘤小时了,且部分患者的疾病出现了长达几年的缓解期,黑色素瘤患者对常见药物组合(纳武
2019年7月24日 讯 /生物谷BIOON/ --在美国,每年有超过1万人被诊断为皮肤癌,转移性黑色素瘤则是一种非常严重的疾病,这种癌症通常从皮肤开始发生,一旦扩散到机体的淋巴结和内脏中时,通常患者几乎没有任何生存机会,然而最近获批的几种检查点抑制剂和BRAF抑制剂药物在一些患者身上出现了戏剧性的反应,患者机体的肿瘤小时了,且部分患者的疾病出现了长达几年的缓解期,黑色素瘤患者对常见药物组合(纳武单抗和易普利姆玛)的反应率通常不到60%。
图片来源:MOLLY THOMPSON
黑色素瘤仅仅是几十种癌症中的一种,目前市场上或临床中使用的免疫疗法能够使得肿瘤得到缓解,同时还并不会给患者带来严重的副作用,但这些免疫强化疗法的反应率仅为12%-65%,取决于具体的癌症类型,目前研究人员并不清楚一些患者反应率较差的原因,几年前研究者Frankel等人开始怀疑微生物组或许在其中扮演着关键角色。
目前这种想法得到了一部分人的支持,比如,在患者进行免疫疗法之前服用抗生素或与患者反应较差直接相关,而且对动物模型的研究也支持了这种因果关联,2013年,研究者Giorgio Trinchieri等人通过研究发现,在给予免疫疗法混合制剂或基于铂的化疗药物之前,利用抗生素治疗无菌小鼠或其它动物或会使其机体对肿瘤的抵抗力变弱,两年后,研究人员进行的两项独立研究结果都表明,黑色素瘤或其它癌症小鼠对化疗的反应率不同或许依赖于机体的肠道微生物群落。
2016年,研究人员通过联合研究收集并分析了30多名接受一种活多种检查点抑制剂免疫疗法的转移性黑色素瘤患者的粪便样本,正如他们推测的那样,他们发现,对疗法有反应的患者机体的微生物组与没有反应的患者存在一定的差异。研究者Frankel等人首次描述了人类机体微生物组组成与免疫疗法治疗结果之间的关联,而且越来越多的研究都阐明了微生物组(尤其是肠道微生物组)对个体对临床疗法的影响,该领域的大部分研究都重点关注癌症疗法,但研究结果表明,帕金森疾病、高胆固醇以及很多其它疾病似乎都会受到患者机体微生物组的影响,一些研究人员认为,在临床上利用这些相互作用改善药物反应之前,需要更好地理解其中的相互作用,而目前正在进行的临床试验正在测定能够改善癌症免疫疗法预后的益生菌制剂或粪便移植。
然而,研究者并不认为通过操控微生物组就能够解决每个人的问题,但益生菌或益生元,无论是以药片形式还是粉末形式,其对于患者而言都比进行积极的干预容易地多。
癌症和肠道微生物组
去年年初,在Science杂志上发表的三篇研究报告都指出了机体中常驻细菌与癌症药物疗效之间的关联,在其中两项研究中,在黑色素瘤患者接受抗PD-1检查点抑制剂之前收集了患者的粪便样本,这些药物能够阻断一种称之为PD-1的受体,癌细胞能利用该受体来抵御机体免疫系统的攻击;这两项研究中,研究人员在对药物反应积极的患者机体中发现了较为丰富的细菌群落,而且将这些患者的细菌群落转移到无菌小鼠体内,能够帮助增强小鼠抵御肿瘤的免疫疗法效应。
尽管上述两项研究之间存在一定的相似之处,但他们发现,患者机体微生物组的特征与疗法反应之间也存在一定差异,研究人员在对免疫疗法治疗成功的患者机体中发现了多种细菌的水平较高,包括长双歧杆菌、产气柯林斯菌和粪肠球菌等。
肠道菌群,系统性的影响
肠道菌群被认为能够调节免疫系统的功能,而且其二者之间的相互作用被认为能够解释微生物组对患者癌症免疫疗法效果的影响。目前研究人员已经提出了几种可行的方法,比如来自肠道菌群的抗原与肿瘤相似,其能训练机体免疫系统去抵御癌症,研究者认为最有可能的就是共生的微生物或能激活机体免疫系统,而有些细菌可能要比其它细菌更具免疫原性,其启动或提高免疫系统功能的第一步,随后就能够更好地抵御癌症了。
的确,对小鼠进行的研究表明,微生物组的组成能够影响某些免疫细胞的活性,比如记忆T细胞和骨髓细胞,2007年,研究人员Chrystal Paulos及其同事发现了一种奇怪的现象,如果动物首先接受了全身放射的话,利用重编程CD8+ T细胞来治疗小鼠机体的肿瘤会使得肿瘤更易于萎缩,研究者表示,放射会损伤肠道内壁细胞,从而释放出共生细菌,这些细菌能积聚在机体的其它部位,从而产生具有免疫刺激性的脂多糖,如果研究人员在整个治疗过程中给予小鼠广谱抗生素来剔除其机体的肠道微生物组的话,小鼠机体中就会产生较少的活化树突状细胞,这些细胞能增强T细胞的功能,给予未照射的小鼠提供抗生素或许并不会对T细胞的治疗产生影响,这就表明,逃离肠道的微生物或许能够介导免疫系统的活性。
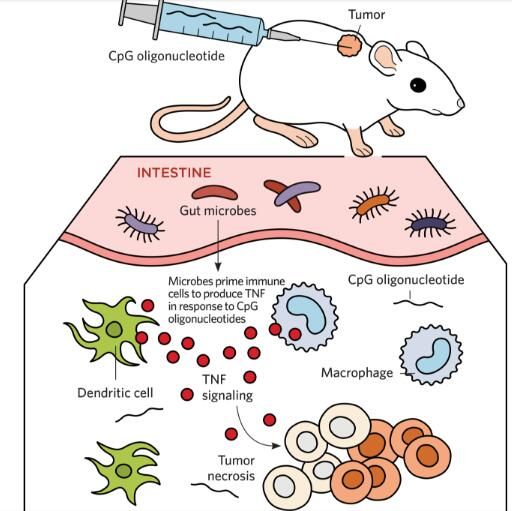
2013年,研究者Trinchieri等人通过研究分析了肠道微生物对肿瘤微环境的影响效应,在研究者利用名为CpG寡脱氧核苷酸的免疫疗法治疗后数小时,利用抗生素治疗的小鼠机体中多种免疫细胞(能产生肿瘤坏死因子)的水平较低,肿瘤坏死因子是CpG寡脱氧核苷酸发挥作用所需要的分子,多项研究结果都阐明了肠道微生物与多种免疫细胞之间的信号串扰,以及微生物组与免疫力之间、甚至是机体对免疫疗法反应之间的密切关联,研究结果表明,利用免疫疗法一起靶向作用肠道菌群或能增强癌症治疗性药物的治疗成功率。
TNF(肿瘤坏死因子)的增强效应
在一项研究中,研究人员发现,当利用CpG寡脱氧核苷酸免疫疗法治疗小鼠时,肠道微生物似乎会诱发小鼠机体的免疫细胞分泌肿瘤坏死因子(TNF),CpG寡脱氧核苷酸是一种短的合成DNA片段,其能帮助刺激免疫系统攻击癌细胞,TNF能够诱导肿瘤坏死。
CD8+ T细胞的辅助
在另一项研究中,利用特殊CD8+ T细胞治疗的小鼠及肠道微生物会通过跨膜蛋白质toll样受体4 (TLR4)来促进树突细胞的成熟,随后成熟的树突细胞会激活CD8+ T细胞,诱导其杀灭肿瘤细胞。
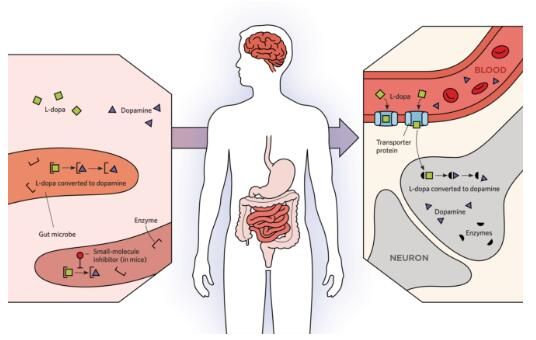
药物代谢和微生物组
除了微生物组与癌症免疫疗法存在一定关联外,科学家们开始将机体自身常驻的微生物与多种条件下药物的疗效相联系起来,药物的效应并不是由免疫系统所介导的,而是能够追溯到细菌的产物岁药物自身的作用,2009年,伦敦帝国理工学院的研究人员发现,尿液中细菌产物对甲酚硫酸盐的水平与机体代谢止痛药对乙酰氨基酚的速率存在一定关联,研究者认为,这是因为对甲酚硫酸盐与对乙酰氨基酚之间存在一定的有效竞争,任一分子都能够接受磺酸盐基团的加成反应。
在其它研究中,研究人员则发现,特定的细菌能够增强药物的疗效,比如,2011年,杜克大学的研究人员通过研究发现,患者对将胆固醇他汀类药物的反应与肠道菌群所产生的三种胆汁酸血液水平直接相关,胆汁酸和他汀类药物能在肝脏和肠道中共享转运蛋白;2014年,来自韩国的研究人员通过研究分析了降胆固醇药物洛伐他汀对小鼠的作用效果,利用抗生素治疗的小鼠机体中他汀类活性β-羟基酸代谢产物的水平较低,而且肠道菌群还会通过其代谢产物对其它药物类型产生反应。
近些年来,代谢组学能够帮助研究人员阐明微生物组对人类机体生理学特性的影响,比如,机体中常驻细菌的代谢过程能够产生比自身细胞还要多的循环分子;今年早些时候,来自格罗宁根大学的科学家们通过研究表示,机体中细菌所产生的酪氨酸脱羧酶水平较高的帕金森病患者或许相比对照而言需要更高剂量的左旋多巴药物进行治疗。
其他研究人员则发现,微生物组对药物代谢所产生的影响,从抗癫痫药物唑尼沙胺到胰岛素,再到激素降钙素,降钙素能用来治疗血液中钙质水平较高及某些骨骼疾病等,的确,最近研究人员发现,276种不同药物中有三分之二的药物都会被机体微生物所修饰。
最后研究者表示,考虑到微生物组所具有的广泛效应,对机体微生物与药物之间相互作用的深入理解或许有望转化为临床医学实践,如果能将其与诸如遗传学等其它类型的信息相结合的话,未来将会使得患者的治疗更加个性化和有效。(生物谷Bioon.com)
参考资料:
【1】N. Iida, “Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment,” Science, 342:967–70, 2013.
【2】A. Sivan et al., “Commensal Bifidobacterium promotes antitumor immunity and facilitates anti–PD-L1 efficacy,” Science, 350:1084–89, 2015.
【3】M. Vétizou et al., “Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota,” Science, 350:1079-84, 2015.
【4】A.E. Frankel et al., “Metagenomic shotgun sequencing and unbiased metabolomic profiling identify specific human gut microbiota and metabolites associated with immune checkpoint therapy efficacy in melanoma patients,” Neoplasia, 19:848–55, 2017.
【5】V. Matson et al., “The commensal microbiome is associated with anti–PD-1 efficacy in metastatic melanoma patients,” Science, 359:104–8, 2018.
【6】V. Gopalakrishnan et al., “Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients,” Science, 359:97–103, 2018.
【7】B. Routy et al., “Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors,” Science, 359:91–97, 2018.
【8】R.Z. Gharaibeh, C. Jobin, “Microbiota and cancer immunotherapy: in search of microbial signals,” Gut, 68:385–88, 2019.
【9】C.M. Paulos et al., “Microbial translocation augments the function of adoptively transferred self/tumor-specific CD8+ T cells via TLR4 signaling,” J Clin Invest, 117:2197–204, 2007.
【10】T.A. Clayton et al., “Pharmacometabonomic identification of a significant host-microbiome metabolic interaction affecting human drug metabolism,” PNAS, 106:14728–33, 2009.
【11】R. Kaddurah-Daouk et al., “Enteric microbiome metabolites correlate with response to simvastatin treatment,” PLOS ONE, 6:e25482, 2011.
【12】D.-H. Yoo et al., “Gut microbiota-mediated drug interactions between lovastatin and antibiotics,” Drug Metab Dispos, 42:1508–13, 2014.
【13】S.P. van Kessel et al., “Gut bacterial tyrosine decarboxylases restrict levels of levodopa in the treatment of Parkinson’s disease,” Nat Commun, 10:310, 2019.
【14】V.M. Rekdal et al., “Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism,” Science, 364:eaau6323, 2019.
【15】M. Zimmermann et al., “Mapping human microbiome drug metabolism by gut bacteria and their genes,” Nature, doi:10.1038/s41586-019-1291-3, 2019.
【16】How the Microbiome Influences Drug Action
Jul 15, 2019,SHAWNA WILLIAMS
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


