2020年2月CRISPR/Cas研究进展
来源:本站原创 2020-02-29 23:53
2020年2月29日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thoma
2020年2月29日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的2月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
doi:10.1126/science.aba7365; doi:10.1126/science.aba9844
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。
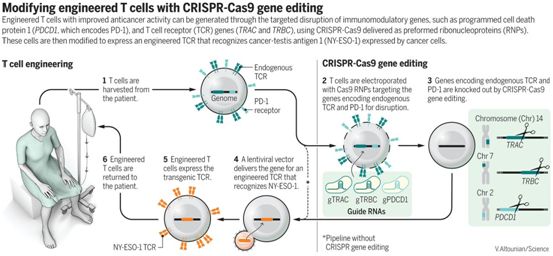
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
这些研究人员先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。他们推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。这些研究人员提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
2.Sci Rep:携带帕金森病突变细胞有助于疾病研究
doi:10.1038/s41598-020-60273-2
在最近一项研究中,科学家们使用基因编辑工具,将疾病相关基因突变引入猴源干细胞中,并成功地抑制了帕金森氏症患者经常会出现细胞生化异常反应。文章作者,威斯康星大学麦迪逊分校Marina Emborg教授说:“我们现在知道如何将一个单一的突变(点突变)插入到猴源干细胞中。”相关结果发表在最近的《Scientific Reports》杂志上。在该研究中,这些研究人员使用基因编辑技术CRISPR来改变细胞遗传密码中的单个核苷酸,并将其命名为G2019S。
在人类帕金森氏症患者中,这种突变导致参与细胞代谢的酶LRRK2过度活跃。这项新研究首次产生了仅产生具有G2019S突变的细胞,这使得研究该突变在疾病中的作用变得更加容易。
3.Science子刊:基因编辑工具CRISPR-Cas9遭遇新挫折!新研究揭示它可导致大量不想要的DNA重复
doi:10.1126/sciadv.aax2941
在一项新的研究中,来自德国明斯特大学的研究人员发现,在小鼠进行常规的CRISPR-Cas9基因插入过程中,不必要的DNA重复频率很高。相关研究结果发表在2020年2月21日的Science Advances期刊上,论文标题为“Pervasive head-to-tail insertions of DNA templates mask desired CRISPR-Cas9–mediated genome editing events”。他们描述了他们如何发现不必要的DNA重复,并针对这一点提醒了其他的研究人员。
这一发现是偶然的,这是因为作为免疫学研究工作的一部分,他们当时正在研究基因S100A8编码的一种钙结合蛋白。为此,他们使用了CRISPR-Cas9来让这个基因无法表达蛋白,这是一种敲除编辑(knockout editing,即利用CRISPR-Cas9基因编辑剔除靶基因)的形式。他们先进行标准的PCR测试和随后进行更专业的PCR测试来检测靶基因,以确保一切按计划进行。研究结果表明,只有两次编辑取得了成功,这让他们感到吃惊。他们接着将一只成功进行基因编辑的小鼠与一只野生小鼠交配,以了解为何编辑成功率如此之低。通过使用一种特殊类型的PCR对小鼠后代进行的测试显示七只小鼠后代携带经过编辑的基因S100A8,其余的小鼠后代具有不想要的DNA重复。
这些研究人员对他们的发现感到震惊,于是他们进行了第二项研究,对小鼠的一个不同基因进行编辑。专业测试显示,在接受测试的50只小鼠中,有30只小鼠具有多个不想要的的基因组片段拷贝,而且这些拷贝是作为CRISPR-Cas9编辑的一部分插入到小鼠基因组中的。实验再次表明,标准PCR测试未能发现这些拷贝。
4.Cell Stem Cell:利用碱基编辑器可以治愈人细胞中的遗传病
doi:10.1016/j.stem.2020.01.019
2012年开发的基因组编辑工具CRISPR/Cas9可以将基因中的突变片段切割掉,并用一个未发生突变的片段进行替换,而一种称为碱基编辑器的新型CRISPR可以在不切割DNA的情况下修复突变。因此,使用碱基编辑器进行基因组编辑被认为更安全。如今,在一项新的研究中,来自荷兰乌得勒支研究所和乌得勒支大学等研究机构的研究人员首次证实碱基编辑器可以安全地治愈源自患者的干细胞中的囊性纤维化(cystic fibrosis)。相关研究结果于2020年02月20日在线发表在Cell Stem Cell期刊上,论文标题为“CRISPR-Based Adenine Editors Correct Nonsense Mutations in a Cystic Fibrosis Organoid Biobank”。论文通讯作者为乌得勒支研究所的Hans Clevers和乌得勒支大学的Jeffrey Beekman。
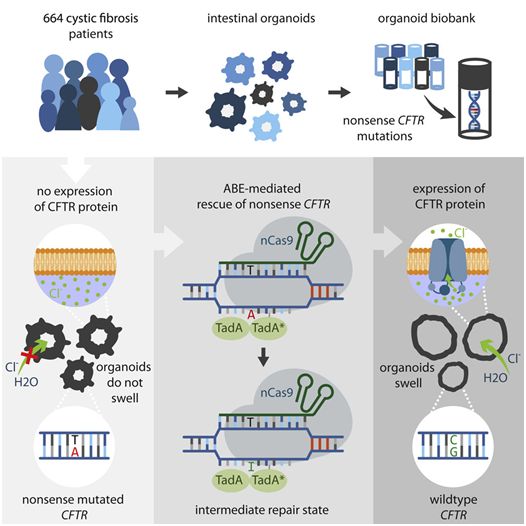
根据乌得勒支研究所生物学家Maarten Geurts和乌得勒支大学生物学家Eyleen de Poel的说法,2018年开发出的一种新的CRISPR酶使得CRISPR技术更精确,更不易出错。Maarten说,“在传统的CRISPR/Cas9基因组中,切割特定的DNA片段会导致DNA损伤。这样做的目的是,细胞使用实验室制造出的'健康'DNA片段来修复这种切割。在称为碱基编辑器的新型CRISPR技术中,对Cas9进行了改进,使得它不再切割DNA,但仍能检测到突变位点,因此,无需切割DNA并替换有缺陷的DNA片段,突变位点可在现场直接修复,从而使得它成为一种更有效的基因组编辑工具。”
当前的这项新的研究表明CRISPR/Cas9的这种新版本(即碱基编辑器)可以安全有效地应用于人类干细胞。
5.APL Bioeng:利用CRISPR打开DNA来消除疾病
doi:10.1063/1.5127302
一种蛋白质编辑辅助因子正在为剪切和粘贴DNA编辑器(如CRISPR)访问以前无法访问的感兴趣基因扫清道路。打开这些遗传密码的区域对于提高CRISPR的效率和迈向未来的、基于基因的疾病治疗是至关重要的。这种DNA结合编辑辅助因子是由一个美国人设计的,他们在APL生物工程中描述了他们的设计。
来自亚利桑那州立大学和埃默里大学的主要作者Karmella Haynes说:"这篇论文的创新之处在于使用了另一种与CRISPR DNA编辑器协同传递的蛋白质,去掉了染色质包装,这样CRISPR就能更容易地获取DNA。"
他们使用了一种完善的人工系统,可以打开或关闭一个基因的染色质包装--荧光素酶基因--它编码一种容易检测到的发光蛋白。在检测染色质填充状态时,研究小组发现了几个编辑助手,他们被称为DNA结合瞬时表达激活相关蛋白(AAPs),破坏了染色质,使CRISPR能够成功编辑荧光素酶基因。
6.基因编辑大牛张锋利用基于CRISPR-Cas13的SHERLOCK系统检测冠状病毒2019-nCoV
新闻来源:A protocol for detection of COVID-19 using CRISPR diagnostics
最近的新型冠状病毒SARS-CoV-2(之前称为2019-nCoV,这种病毒感染导致的疾病称为COVID-19)疫情给全球健康带来了巨大挑战。为了应对这一全球挑战,美国布罗德研究所、麦戈文脑科学硏究所及其合作机构致力于提供潜在有用的信息,包括分享可能能够支持开发潜在诊断方法的信息。
作为采取的应对措施的一部分,张锋(Feng Zhang)、Omar Abudayyeh和Jonathan Gootenberg开发了适用于纯化的RNA的研究方案,这可能有助于开发基于CRISPR的诊断方法来临床检测2019-nCoV。这个研究方案包括三个步骤。它可以用于测试当前从临床样本中提取的用于定量PCR(qPCR)测试的RNA:步骤1:将提取出的RNA在42℃下等温扩增反应25分钟;步骤2:让步骤1中的扩增产物与Cas13蛋白、gRNA和报告分子在37℃下孵育30分钟;步骤3:将试纸条浸入步骤2中的反应产物溶液中,结果应当在5分钟内出现。
这种初始的研究方案并不是诊断性的测试方法,而且尚未在患者样本上进行测试。任何诊断方法都需要针对临床用途进行开发和验证,并且需要遵循所有当地法规和最佳实践。尽管如此,这种研究方案仍然为使用试纸条建立基于SHERLOCK的2019-nCoV诊断方法提供了基本框架。
7.Nature:从地球不同环境中发现351种新的巨大噬菌体,它们模糊了病毒和细菌之间的界线
doi:10.1038/s41586-020-2007-4
在一项新的研究中,来自美国加州大学伯克利分校、科罗拉多州立大学、斯坦福大学、美国能源部联合基因组研究所、匹兹堡大学医学院、中国中山大学、南非开普敦大学、法国国家科学研究中心、英国伦敦大学学院、澳大利亚墨尔本大学、丹麦技术大学、日本原子能机构和加拿大多伦多大学的研究人员发现了数百种异常大的、能杀死细菌的病毒,它们通常具有与活的有机体相关的功能,这模糊了活的细菌与病毒之间的界线。相关研究结果于2020年2月12日在线发表在Nature期刊上,论文标题为“Clades of huge phages from across Earth’s ecosystems”。论文通讯作者为加州大学伯克利分校的Jill Banfield教授。论文第一作者为加州大学伯克利分校研究生Basem Al-Shayeb和研究助理Rohan Sachdeva。
这些研究人员通过搜索庞大的DNA数据库来发现这些巨大噬菌体(huge phage,也称为megaphage),这些DNA数据库是从将近30种不同的地球环境---从早产儿和孕妇的肠道到西藏温泉、病房、海洋、湖泊和深层地下---中产生的。他们总共鉴定出351种不同的巨大噬菌体,它们的基因组比吞噬单细胞细菌的病毒的平均基因组大4倍或更多倍。在它们当中,存在迄今为止发现的一种最大的噬菌体:它的基因组长735000个碱基(即735kb),比噬菌体的平均基因组大近15倍。这个已知最大的噬菌体基因组比许多细菌的基因组大得多。
具有讽刺意味的是,在这些巨大噬菌体所携带的DNA中,存在细菌用来对抗病毒的CRISPR系统的一部分。很有可能发生的情形是,一旦这些噬菌体将它们的DNA注入细菌,这种病毒CRISPR系统就会增强宿主细菌的CRISPR系统,很可能主要是让细菌CRISPR系统靶向其他病毒。
这些巨大噬菌体中的一种也能够制造一种类似于Cas9蛋白的蛋白,Cas9是由加州大学伯克利分校的Jennifer Doudna和她的欧洲同事Emmanuelle Charpentier改进的用于基因编辑的革命性工具CRISPR-Cas9的一部分。这些研究人员将这种微小的蛋白称为CasØ,这是因为希腊字母Ø或phi通常被用来表示噬菌体。
Sachdeva说,“在这些巨大噬菌体中,寻找用于基因组工程的新工具的潜力很大。我们发现的许多基因都是未知的,它们没有假定的功能,可能是工业、医学或农业应用中新蛋白的来源。”
8.Sci Adv:CRISPR基因编辑能够修复遗传性肝损伤
doi:10.1126/sciadv.aax5701
近日,来自宾夕法尼亚大学医学院的研究人员在《Science Advance》杂志上在线发表的研究表明,一项新的CRISPR基因编辑技术可预防一中由数百种不同突变驱动的遗传性肝病的发生,并改善了小鼠的临床症状。研究结果表明,这种有前途的CRISPR工具可以潜在地治疗因鸟氨酸转氨甲酰酶(OTC)缺乏以及其它同基因不同位点的突变导致的罕见代谢尿素循环异常的患者。
这种CRISPR基因编辑方法建立在以前相同研究团队开发的方法的基础上。这次,研究者们采用了一种新型的双重腺相关病毒(AAV)来传递其有效成分,通过将“小基因”插入基因组中,以在肝细胞中实现OTC的持续表达。 与此前纠正单点突变的治疗方法相比,这种“剪切”-“粘贴”的方法能够显著改善新生小鼠的临床,并且能够持续到成年。
“就像大多数对新生儿具有致命影响的遗传性疾病一样,长期有效的早期治疗至关重要。”文章作者,基因治疗计划和基因治疗主任James Wilson博士说。 “在这里,我们进一步改善了CRISPR技术,不仅可以维持细胞中OTC的表达,还可以扩展其治疗能力。我们的目标是最终将这种基因编辑方法向临床阶段转化,以治疗患有OTC障碍和其他遗传疾病的患者分散在整个基因中的突变,而非单个突变。”
9.华人科学家最新两篇Nature Biotechnology构建出超精准的碱基编辑器
doi:10.1038/s41587-020-0414-6; doi:10.1038/s41587-020-0412-8
基于CRISPR的基因编辑具有潜在的治疗优势,但也存在一些技术缺陷。在这些基因编辑工具中,碱基编辑器可以重写组成DNA的四个碱基---腺嘌呤(A)、胞嘧啶(C)、胸腺嘧啶(T)和鸟嘌呤(G)---之一。
如今,在两项新的研究中,来自美国布罗德研究所和霍华德休斯医学研究所的研究人员发明了新的CRISPR工具,这些工具通过改进碱基编辑器的精确度和基因组靶向能力解决了它们面临的一些挑战。相关研究结果于2020年2月10日在线发表在Nature Biotechnology期刊上的论文中,论文标题分别为“Evaluation and minimization of Cas9-independent off-target DNA editing by cytosine base editors”和“Continuous evolution of SpCas9 variants compatible with non-G PAMs”
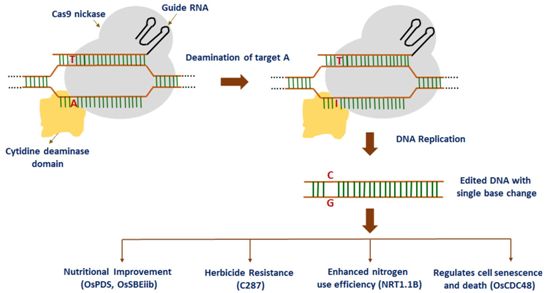
在第一项新的研究中,这些研究人员设计出新的胞嘧啶碱基编辑器,将一种难以捉摸的脱靶编辑减少了10~100倍,从而使得这些新的胞嘧啶碱基编辑器特别有望用于治疗人类疾病。在第二项新的研究中,他们通过让现有的Cas9蛋白进化而获得了新一代CRISPR-Cas9蛋白,它们能够靶向更大部分的致病突变,包括一种导致镰形细胞贫血的突变。在此之前,这种突变仍然很难通过以前的CRISPR方法加以靶向。
这两篇论文的通讯作者、布罗德研究员默金医疗变革技术研究所所长、哈佛大学化学与化学生物学教授、霍华德休斯医学研究所研究员David Liu说,“鉴于人类基因组编辑时代尚处于脆弱的起步阶段,因此,当我们开始将这些基因编辑器导入人体时,我们应尽一切努力将任何不良影响的风险降至最低,这一点很重要。将这种难以捉摸的脱靶编辑--- Cas9非依赖性编辑(Cas9-independent edit,即不依赖于Cas9的编辑)---减到最少是实现这一目标的重要一步。这种脱靶编辑可以在基因组的随机位置上发生。当你进行10次实验时,你会得到10个不同的答案。这使得研究这一点极具挑战性。”(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的2月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
doi:10.1126/science.aba7365; doi:10.1126/science.aba9844
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。

图片来自Science, 2020, doi:10.1126/science.aba9844。
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
这些研究人员先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。他们推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。这些研究人员提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
2.Sci Rep:携带帕金森病突变细胞有助于疾病研究
doi:10.1038/s41598-020-60273-2
在最近一项研究中,科学家们使用基因编辑工具,将疾病相关基因突变引入猴源干细胞中,并成功地抑制了帕金森氏症患者经常会出现细胞生化异常反应。文章作者,威斯康星大学麦迪逊分校Marina Emborg教授说:“我们现在知道如何将一个单一的突变(点突变)插入到猴源干细胞中。”相关结果发表在最近的《Scientific Reports》杂志上。在该研究中,这些研究人员使用基因编辑技术CRISPR来改变细胞遗传密码中的单个核苷酸,并将其命名为G2019S。
在人类帕金森氏症患者中,这种突变导致参与细胞代谢的酶LRRK2过度活跃。这项新研究首次产生了仅产生具有G2019S突变的细胞,这使得研究该突变在疾病中的作用变得更加容易。
3.Science子刊:基因编辑工具CRISPR-Cas9遭遇新挫折!新研究揭示它可导致大量不想要的DNA重复
doi:10.1126/sciadv.aax2941
在一项新的研究中,来自德国明斯特大学的研究人员发现,在小鼠进行常规的CRISPR-Cas9基因插入过程中,不必要的DNA重复频率很高。相关研究结果发表在2020年2月21日的Science Advances期刊上,论文标题为“Pervasive head-to-tail insertions of DNA templates mask desired CRISPR-Cas9–mediated genome editing events”。他们描述了他们如何发现不必要的DNA重复,并针对这一点提醒了其他的研究人员。
这一发现是偶然的,这是因为作为免疫学研究工作的一部分,他们当时正在研究基因S100A8编码的一种钙结合蛋白。为此,他们使用了CRISPR-Cas9来让这个基因无法表达蛋白,这是一种敲除编辑(knockout editing,即利用CRISPR-Cas9基因编辑剔除靶基因)的形式。他们先进行标准的PCR测试和随后进行更专业的PCR测试来检测靶基因,以确保一切按计划进行。研究结果表明,只有两次编辑取得了成功,这让他们感到吃惊。他们接着将一只成功进行基因编辑的小鼠与一只野生小鼠交配,以了解为何编辑成功率如此之低。通过使用一种特殊类型的PCR对小鼠后代进行的测试显示七只小鼠后代携带经过编辑的基因S100A8,其余的小鼠后代具有不想要的DNA重复。
这些研究人员对他们的发现感到震惊,于是他们进行了第二项研究,对小鼠的一个不同基因进行编辑。专业测试显示,在接受测试的50只小鼠中,有30只小鼠具有多个不想要的的基因组片段拷贝,而且这些拷贝是作为CRISPR-Cas9编辑的一部分插入到小鼠基因组中的。实验再次表明,标准PCR测试未能发现这些拷贝。
4.Cell Stem Cell:利用碱基编辑器可以治愈人细胞中的遗传病
doi:10.1016/j.stem.2020.01.019
2012年开发的基因组编辑工具CRISPR/Cas9可以将基因中的突变片段切割掉,并用一个未发生突变的片段进行替换,而一种称为碱基编辑器的新型CRISPR可以在不切割DNA的情况下修复突变。因此,使用碱基编辑器进行基因组编辑被认为更安全。如今,在一项新的研究中,来自荷兰乌得勒支研究所和乌得勒支大学等研究机构的研究人员首次证实碱基编辑器可以安全地治愈源自患者的干细胞中的囊性纤维化(cystic fibrosis)。相关研究结果于2020年02月20日在线发表在Cell Stem Cell期刊上,论文标题为“CRISPR-Based Adenine Editors Correct Nonsense Mutations in a Cystic Fibrosis Organoid Biobank”。论文通讯作者为乌得勒支研究所的Hans Clevers和乌得勒支大学的Jeffrey Beekman。

图片来自Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.01.019。
根据乌得勒支研究所生物学家Maarten Geurts和乌得勒支大学生物学家Eyleen de Poel的说法,2018年开发出的一种新的CRISPR酶使得CRISPR技术更精确,更不易出错。Maarten说,“在传统的CRISPR/Cas9基因组中,切割特定的DNA片段会导致DNA损伤。这样做的目的是,细胞使用实验室制造出的'健康'DNA片段来修复这种切割。在称为碱基编辑器的新型CRISPR技术中,对Cas9进行了改进,使得它不再切割DNA,但仍能检测到突变位点,因此,无需切割DNA并替换有缺陷的DNA片段,突变位点可在现场直接修复,从而使得它成为一种更有效的基因组编辑工具。”
当前的这项新的研究表明CRISPR/Cas9的这种新版本(即碱基编辑器)可以安全有效地应用于人类干细胞。
5.APL Bioeng:利用CRISPR打开DNA来消除疾病
doi:10.1063/1.5127302
一种蛋白质编辑辅助因子正在为剪切和粘贴DNA编辑器(如CRISPR)访问以前无法访问的感兴趣基因扫清道路。打开这些遗传密码的区域对于提高CRISPR的效率和迈向未来的、基于基因的疾病治疗是至关重要的。这种DNA结合编辑辅助因子是由一个美国人设计的,他们在APL生物工程中描述了他们的设计。
来自亚利桑那州立大学和埃默里大学的主要作者Karmella Haynes说:"这篇论文的创新之处在于使用了另一种与CRISPR DNA编辑器协同传递的蛋白质,去掉了染色质包装,这样CRISPR就能更容易地获取DNA。"
他们使用了一种完善的人工系统,可以打开或关闭一个基因的染色质包装--荧光素酶基因--它编码一种容易检测到的发光蛋白。在检测染色质填充状态时,研究小组发现了几个编辑助手,他们被称为DNA结合瞬时表达激活相关蛋白(AAPs),破坏了染色质,使CRISPR能够成功编辑荧光素酶基因。
6.基因编辑大牛张锋利用基于CRISPR-Cas13的SHERLOCK系统检测冠状病毒2019-nCoV
新闻来源:A protocol for detection of COVID-19 using CRISPR diagnostics
最近的新型冠状病毒SARS-CoV-2(之前称为2019-nCoV,这种病毒感染导致的疾病称为COVID-19)疫情给全球健康带来了巨大挑战。为了应对这一全球挑战,美国布罗德研究所、麦戈文脑科学硏究所及其合作机构致力于提供潜在有用的信息,包括分享可能能够支持开发潜在诊断方法的信息。
作为采取的应对措施的一部分,张锋(Feng Zhang)、Omar Abudayyeh和Jonathan Gootenberg开发了适用于纯化的RNA的研究方案,这可能有助于开发基于CRISPR的诊断方法来临床检测2019-nCoV。这个研究方案包括三个步骤。它可以用于测试当前从临床样本中提取的用于定量PCR(qPCR)测试的RNA:步骤1:将提取出的RNA在42℃下等温扩增反应25分钟;步骤2:让步骤1中的扩增产物与Cas13蛋白、gRNA和报告分子在37℃下孵育30分钟;步骤3:将试纸条浸入步骤2中的反应产物溶液中,结果应当在5分钟内出现。
这种初始的研究方案并不是诊断性的测试方法,而且尚未在患者样本上进行测试。任何诊断方法都需要针对临床用途进行开发和验证,并且需要遵循所有当地法规和最佳实践。尽管如此,这种研究方案仍然为使用试纸条建立基于SHERLOCK的2019-nCoV诊断方法提供了基本框架。
7.Nature:从地球不同环境中发现351种新的巨大噬菌体,它们模糊了病毒和细菌之间的界线
doi:10.1038/s41586-020-2007-4
在一项新的研究中,来自美国加州大学伯克利分校、科罗拉多州立大学、斯坦福大学、美国能源部联合基因组研究所、匹兹堡大学医学院、中国中山大学、南非开普敦大学、法国国家科学研究中心、英国伦敦大学学院、澳大利亚墨尔本大学、丹麦技术大学、日本原子能机构和加拿大多伦多大学的研究人员发现了数百种异常大的、能杀死细菌的病毒,它们通常具有与活的有机体相关的功能,这模糊了活的细菌与病毒之间的界线。相关研究结果于2020年2月12日在线发表在Nature期刊上,论文标题为“Clades of huge phages from across Earth’s ecosystems”。论文通讯作者为加州大学伯克利分校的Jill Banfield教授。论文第一作者为加州大学伯克利分校研究生Basem Al-Shayeb和研究助理Rohan Sachdeva。
这些研究人员通过搜索庞大的DNA数据库来发现这些巨大噬菌体(huge phage,也称为megaphage),这些DNA数据库是从将近30种不同的地球环境---从早产儿和孕妇的肠道到西藏温泉、病房、海洋、湖泊和深层地下---中产生的。他们总共鉴定出351种不同的巨大噬菌体,它们的基因组比吞噬单细胞细菌的病毒的平均基因组大4倍或更多倍。在它们当中,存在迄今为止发现的一种最大的噬菌体:它的基因组长735000个碱基(即735kb),比噬菌体的平均基因组大近15倍。这个已知最大的噬菌体基因组比许多细菌的基因组大得多。
具有讽刺意味的是,在这些巨大噬菌体所携带的DNA中,存在细菌用来对抗病毒的CRISPR系统的一部分。很有可能发生的情形是,一旦这些噬菌体将它们的DNA注入细菌,这种病毒CRISPR系统就会增强宿主细菌的CRISPR系统,很可能主要是让细菌CRISPR系统靶向其他病毒。
这些巨大噬菌体中的一种也能够制造一种类似于Cas9蛋白的蛋白,Cas9是由加州大学伯克利分校的Jennifer Doudna和她的欧洲同事Emmanuelle Charpentier改进的用于基因编辑的革命性工具CRISPR-Cas9的一部分。这些研究人员将这种微小的蛋白称为CasØ,这是因为希腊字母Ø或phi通常被用来表示噬菌体。
Sachdeva说,“在这些巨大噬菌体中,寻找用于基因组工程的新工具的潜力很大。我们发现的许多基因都是未知的,它们没有假定的功能,可能是工业、医学或农业应用中新蛋白的来源。”
8.Sci Adv:CRISPR基因编辑能够修复遗传性肝损伤
doi:10.1126/sciadv.aax5701
近日,来自宾夕法尼亚大学医学院的研究人员在《Science Advance》杂志上在线发表的研究表明,一项新的CRISPR基因编辑技术可预防一中由数百种不同突变驱动的遗传性肝病的发生,并改善了小鼠的临床症状。研究结果表明,这种有前途的CRISPR工具可以潜在地治疗因鸟氨酸转氨甲酰酶(OTC)缺乏以及其它同基因不同位点的突变导致的罕见代谢尿素循环异常的患者。
这种CRISPR基因编辑方法建立在以前相同研究团队开发的方法的基础上。这次,研究者们采用了一种新型的双重腺相关病毒(AAV)来传递其有效成分,通过将“小基因”插入基因组中,以在肝细胞中实现OTC的持续表达。 与此前纠正单点突变的治疗方法相比,这种“剪切”-“粘贴”的方法能够显著改善新生小鼠的临床,并且能够持续到成年。
“就像大多数对新生儿具有致命影响的遗传性疾病一样,长期有效的早期治疗至关重要。”文章作者,基因治疗计划和基因治疗主任James Wilson博士说。 “在这里,我们进一步改善了CRISPR技术,不仅可以维持细胞中OTC的表达,还可以扩展其治疗能力。我们的目标是最终将这种基因编辑方法向临床阶段转化,以治疗患有OTC障碍和其他遗传疾病的患者分散在整个基因中的突变,而非单个突变。”
9.华人科学家最新两篇Nature Biotechnology构建出超精准的碱基编辑器
doi:10.1038/s41587-020-0414-6; doi:10.1038/s41587-020-0412-8
基于CRISPR的基因编辑具有潜在的治疗优势,但也存在一些技术缺陷。在这些基因编辑工具中,碱基编辑器可以重写组成DNA的四个碱基---腺嘌呤(A)、胞嘧啶(C)、胸腺嘧啶(T)和鸟嘌呤(G)---之一。
如今,在两项新的研究中,来自美国布罗德研究所和霍华德休斯医学研究所的研究人员发明了新的CRISPR工具,这些工具通过改进碱基编辑器的精确度和基因组靶向能力解决了它们面临的一些挑战。相关研究结果于2020年2月10日在线发表在Nature Biotechnology期刊上的论文中,论文标题分别为“Evaluation and minimization of Cas9-independent off-target DNA editing by cytosine base editors”和“Continuous evolution of SpCas9 variants compatible with non-G PAMs”

图片来自Frontiers in Plant Science, 2018, doi:10.3389/fpls.2018.01361。
在第一项新的研究中,这些研究人员设计出新的胞嘧啶碱基编辑器,将一种难以捉摸的脱靶编辑减少了10~100倍,从而使得这些新的胞嘧啶碱基编辑器特别有望用于治疗人类疾病。在第二项新的研究中,他们通过让现有的Cas9蛋白进化而获得了新一代CRISPR-Cas9蛋白,它们能够靶向更大部分的致病突变,包括一种导致镰形细胞贫血的突变。在此之前,这种突变仍然很难通过以前的CRISPR方法加以靶向。
这两篇论文的通讯作者、布罗德研究员默金医疗变革技术研究所所长、哈佛大学化学与化学生物学教授、霍华德休斯医学研究所研究员David Liu说,“鉴于人类基因组编辑时代尚处于脆弱的起步阶段,因此,当我们开始将这些基因编辑器导入人体时,我们应尽一切努力将任何不良影响的风险降至最低,这一点很重要。将这种难以捉摸的脱靶编辑--- Cas9非依赖性编辑(Cas9-independent edit,即不依赖于Cas9的编辑)---减到最少是实现这一目标的重要一步。这种脱靶编辑可以在基因组的随机位置上发生。当你进行10次实验时,你会得到10个不同的答案。这使得研究这一点极具挑战性。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


