Immunity解读!对机体肠道的连环出击或会诱发多发性硬化症
来源:本站原创 2020-11-24 23:09
2020年11月25日 讯 /生物谷BIOON/ --微生物组在多发性硬化症发病过程中扮演着关键角色,最近一篇发表在Nature杂志上的研究报告中,研究者Miyauchi等人表示,肠道微生物分子或能与增强Th17细胞的肠道微生物一起协同作用来恶化机体中枢神经系统自身免疫特性。近日,一篇刊登在国际杂志Immunity上题为“A One-Two Punch in
2020年11月25日 讯 /生物谷BIOON/ --微生物组在多发性硬化症发病过程中扮演着关键角色,最近一篇发表在Nature杂志上的研究报告中,研究者Miyauchi等人表示,肠道微生物分子或能与增强Th17细胞的肠道微生物一起协同作用来恶化机体中枢神经系统自身免疫特性。近日,一篇刊登在国际杂志Immunity上题为“A One-Two Punch in the Gut May Trigger Multiple Sclerosis”的综述文章中,来自哈佛医学院的科学家们论述了如何对肠道连环出击来诱发多发性硬化症。
最近研究揭示了微生物组在多发性硬化症病理生理学中所扮演的关键角色,在多发性硬化症动物模型(实验性自身免疫性脑脊髓炎,EAE)的早期观察研究中,研究者发现,口服而非腹腔注射抗生素治疗的疗法能够改善小鼠模型的疾病,而无菌小鼠则对EAE存在一定的抵抗力,此外,将多发性硬化症微生物菌群转移到小鼠机体会加剧其机体EAE的表现,与健康对照组相比,多发性硬化症患者机体中的微生物组发生了明显改变,尽管已经取得了这些研究发现,但目前研究人员仍然并不清楚微生物组影响疾病的分子机制;然而存在多种非相互排斥的可能性,包括:1)微生物和中枢神经系统抗原之间交叉反应的分子模拟或会扩张自身反应性的T细胞;2)对先天性免疫系统的佐剂样效应或会使得T细胞极化为Th1/Th17细胞表型;3)分泌的代谢产物会影响神经系统和免疫系统。
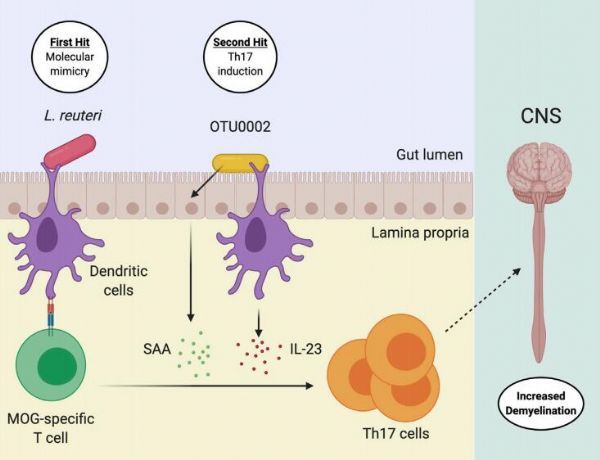
图片来源:Amir-Hadi Maghzi et al. Immunity (2020) doi:10.1016/j.immuni.2020.09.016
研究者Miyauchi等人通过研究深入理解的微生物组诱发中枢神经系统自身免疫性的分子机制,他们发现韦荣球菌科家族(OTU002,Erysipelotrichaceae family)和罗伊氏乳杆菌 (L. reuteri)之间的协同效应或会通过增强Th17细胞的反应和对髓鞘少突胶质细胞糖蛋白(MOG)的分子模拟来使得EAE恶化。利用包括氨苄西林、万古霉素、新霉素和甲硝唑在内的四种抗生素的混合制剂疗法就能够减轻EAE的严重性并减轻患者机体的促炎性反应;研究者Miyauchi等人通过让EAE受试动物分别口服四种抗生素来研究其所产生的效应,结果发现,氨苄西林是唯一一种能够减缓EAE的抗渗骨髓,随后研究者以经历EAE的动物机体肠道相关的淋巴组织为研究对象分析了MOG特异性的T细胞反应,结果发现小鼠肠道固有层的反应最为强烈,而且当其接受氨苄西林治疗后机体症状明显减轻了。研究者对氨苄西林治疗的小鼠机体的小肠微生物进行了测序分析,结果发现了一种属于韦荣球菌科家族的成员—OTU002。
随后研究人员转向对限菌(gnotobiotic)小鼠进行研究来评估OTU002在EAE发病过程中扮演的关键角色,限菌系统能被典型地用来识别单个微生物在肠道中所扮演的关键角色,而这并不受其它细菌的干扰,无菌小鼠定植的方法可能有其自身的局限性,因为与常规培养的小鼠相比,在无菌条件下初始培养的小鼠机体的免疫系统并不成熟,而且对于EAE的诱导会产生抗性。研究者发现,与无菌小鼠或携带对照菌群的小鼠相比,携带OTU0002的无菌小鼠机体EAE的病情或许会更加严重,而且其小肠固有层中Th17细胞的诱导率也更高一些。研究者发现,OTU0002能通过佐剂效应来诱导Th17细胞,这类似于在分段裂殖菌中所观察到的情况,其能诱导上皮细胞中的血清淀粉样蛋白A和树突细胞中的白介素23(IL-23),值得注意的是,研究者还在受试动物中观察到了Treg细胞水平的增加,其似乎并未提供调节功能,尽管Treg细胞并没有被定性分析。
研究者Miyauchi等人通过阐明肠道微生物或会通过不同的机制来协同作用促进疾病的发生,从而深入理解了微生物组在机体中枢神经系统自身免疫性中所扮演的角色,阐明这种协同作用或许还需要一种归纳方法,即利用两种细菌在无菌小鼠体内定植,尽管如此,在动物模型中,诸如罗伊氏乳杆菌等单一细菌可能会对中枢神经系统产生有益或有害的影响,而这取决于不同的作用机制以及病程中的关键时间。尽管目前研究人员已经开始利用益生菌对多发性硬化症患者进行相应的临床试验,同时揭示了机体的免疫改变和肠道微生物组的调节作用,但目前并没有临床数据表明益生菌能够调节多发性硬化症的严重性,值得注意的是,罗伊氏乳杆菌出现在了一些非处方的益生菌补充剂中,而基于动物研究,这些补充剂或许能够潜在减缓或增强疾病的发生。目前研究人员需要进行更为深入的研究来评估罗伊氏乳杆菌和OUT0002在多发性硬化症受试者微生物组中出现的频率,以及其如何与患者疾病的临床和免疫组分之间相关联的。在动物体内诱导EAE需要一种中枢神经系统的抗原加上Th1/Th17极化佐剂进行免疫,从而来诱导致病性的T细胞反应,很有可能是这两种组分自然存在于机体肠道中,并连续出击诱发人类多发性硬化症的发生。(生物谷Bioon.com)
参考资料:
Amir-Hadi Maghzi,Howard L.Weiner. A One-Two Punch in the Gut May Trigger Multiple Sclerosis, Immunity (2020) doi:10.1016/j.immuni.2020.09.016
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。