靶向诺奖信号通路!这家公司要用RNAi疗法治疗心血管疾病、NASH和癌症
来源:药明康德 2019-10-21 12:36
关于RNAi的突破性研究早在2006年就摘得了诺贝尔生理学或医学奖的桂冠,然而,第一款RNAi疗法却直到2018年8月才获得FDA批准。如今,虽然RNAi疗法作为一种治疗模式得到了业界的认可,但是大多数在研疗法治疗的是患者人数相对较少的罕见疾病。那么,RNAi这种创新治疗模式,能够在治疗患者数目众多的大众疾病中发挥威力么?今年8月,The Medicines Company宣布该公司与
关于RNAi的突破性研究早在2006年就摘得了诺贝尔生理学或医学奖的桂冠,然而,第一款RNAi疗法却直到2018年8月才获得FDA批准。如今,虽然RNAi疗法作为一种治疗模式得到了业界的认可,但是大多数在研疗法治疗的是患者人数相对较少的罕见疾病。那么,RNAi这种创新治疗模式,能够在治疗患者数目众多的大众疾病中发挥威力么?
今年8月,The Medicines Company宣布该公司与Alnylam Pharmaceuticals公司联合开发的RNAi疗法inclisiran,在降低低密度脂蛋白胆固醇(LDL-C)的关键性临床试验中达到所有主要和次要终点,展现了RNAi疗法在治疗大众疾病方面的潜力。
今日,RNAi疗法公司Arrowhead Pharmacuticals召开了投资者会议。该公司介绍的早期研发项目显示,除了罕见疾病以外,RNAi在治疗心血管疾病(CAD),非酒精性脂肪性肝炎(NASH),以及癌症等大众疾病方面也具有广阔的前景。其中,该公司将使用RNAi这一曾经获得诺贝尔奖的突破性技术,靶向今年获得诺贝尔奖的“氧感知通路”!
Arrowhead公司是RNAi疗法开发领域的中坚力量。该公司的研发管线中,具有潜在治愈乙肝能力的RNAi疗法JNJ-3989目前处于2期临床试验阶段,它已经授权给强生(Johnson & Johnson)集团旗下的杨森(Janssen)公司进行进一步开发。它还与安进(Amgen)公司达成研发合作。
Arrowhead的RNAi技术平台称为TRiM,是靶向RNAi分子(Targeted RNAi Molecule)的简称。该公司基于对RNAi分子形成过程中每一步的深入研究,能够对在研RNAi疗法的稳定性,药代动力学特性,以及靶向递送能力进行优化。通过改变与RNAi分子偶联的靶向化合物,这一平台能够将RNAi疗法有特异性地递送到不同的组织中,从而提高治疗不同类型疾病的效率。Arrowhead公司总裁兼首席执行官Chris Anzalone博士表示,预计在今后一年多的时间里,该公司将有至少7款RNAi疗法进入临床试验阶段,其中3款疗法将进入3期临床阶段。下面我们来看一看其中几款有望治疗大众疾病的早期在研疗法。
降低心血管疾病风险的RNAi疗法
心血管疾病是除了癌症以外,世界上导致死亡的重要原因之一。而血液中过高的胆固醇水平和甘油三酯(TG)水平都会提高人们患上心血管疾病的风险。目前已经有多款降低LDL-C的疗法上市,包括他汀类药物和PCSK9抑制剂,然而针对性降低甘油三酯水平的疗法并不多。
Arrowhead公司的两款在研RNAi疗法的靶点是在肝脏中表达的APOC3和ANGPTL3蛋白。这两种蛋白在脂质代谢中起到抑制脂蛋白脂肪酶(lipoprotein lipase, LPL)活性的作用,导致TG和LDL-C水平升高。人类遗传学研究表明,天然携带APOC3和ANGPTL3基因缺失的杂合子个体的心血管疾病患病风险下降40%左右,而且这些个体的LDL-C和TG水平都显着下降。
基于这些数据和靶向APOC3和ANGPTL3的反义寡核苷酸药物(ASO)和抗体的表现,Arrowhead开发了靶向APOC3和ANGPTL3 mRNA的RNAi疗法。在1期临床试验中,这两款RNAi疗法不但成功降低了血清中APOC3和ANGPTL3的水平,而且将血清中的TG水平降低了60%左右。一次皮下注射可以将TG水平降低至少12周。
Arrowhead计划在2020年启动这两款疗法的关键性3期临床研究。该公司高管表示,这两款RNAi疗法可以用于治疗由于遗传原因导致TG水平过高的罕见病患者人群,也可以用于作为预防疗法,与其它降脂疗法联用,降低大众人群的LDL-C和TG水平。
治疗NASH的RNAi疗法
全球范围内,1/4人口已成为非酒精性脂肪性肝病(NAFLD)患者,而其中发展为NASH的人群也超过1亿。目前,众多生物医药公司在开发针对NASH的创新疗法,然而针对NASH的药物研发目前并不顺利,目前尚未有疗法获得FDA批准。
去年在《新英格兰医学杂志》(NEJM)上的一项研究表明,一种名为HSD17B13的基因上出现的功能缺失变异与慢性肝病风险降低,以及脂肪变性进展为脂肪性肝炎的风险降低相关。这意味着,降低这一基因的表达,可能防止NAFLD进一步进展为NASH,以及防止NASH患者进一步出现肝脏纤维化和肝硬化。
Arrowhead针对这一新出炉的靶点设计了一款RNAi疗法,抑制这一基因表达的HSD17β13蛋白的产生。在小鼠的NASH模型中,它成功减低了动物的炎症反应、肝细胞退化,以及肝纤维化的产生。该公司计划在今年年底之前递交临床试验申请(CTA),预计在2020年上半年开始临床试验。
诺奖技术靶向诺奖信号通路
今年,关于“氧感知通路”的突破性研究获得了诺贝尔生理学或医学奖。其中丹娜·法伯癌症研究所(Dana Farber Cancer Institute)的威廉·凯林(William Kaelin)教授,通过对希佩尔-林道综合征(von Hippel-Lindau disease)的研究,发现了名为VHL的蛋白能够调节在氧感知通路中起到关键作用的缺氧诱导因子(HIF)的泛素修饰,从而导致HIF的降解。重要的是,这一调控机制在很多肿瘤中起到重要作用。例如,肾癌患者的VHL基因往往会出现突变,导致肿瘤产生过量的血管内皮生长因子(VEGF),从而促进血管和红细胞的生成,为肿瘤提供更多氧气和营养。基于这一原理,药物研发人员开发出了靶向VEGF的抑制剂。
同时,HIF蛋白也成为药物研发人员关注的热门靶点,目前有多款HIF-1和HIF-2抑制剂处于临床前开发阶段,默沙东(MSD)公司也在今年5月斥资22亿美元收购了Peleton公司,以及该公司处于2期临床试验的HIF-2α抑制剂。
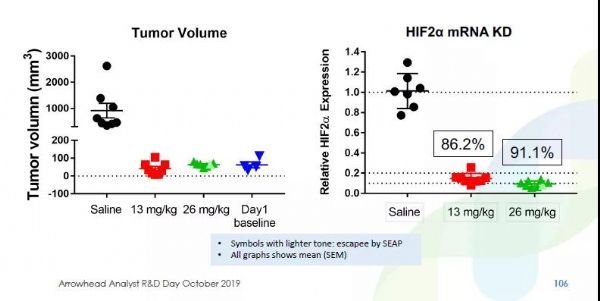
Arrowhead针对HIF-2α设计了一款RNAi疗法。通常RNAi疗法的靶向组织为肝脏,而这款名为ARO-HIF2的疗法是该公司开发的首款全身性RNAi疗法。ARO-HIF2在RNAi分子上连接了一种能够识别在多种癌症类型中高度表达的受体(αVβ3),从而让RNAi分子能够有特异性地靶向肿瘤中编码HIF2α的mRNA,将脱靶效应最小化。
在小鼠模型中,一次ARO-HIF2注射能够将动物体内HIF2α mRNA的表达降低80%以上。重要的是,在肿瘤移植模型中,这款RNAi疗法能够在不同剂量显着降低肿瘤的增生。
Arrowhead公司已经完成了支持IND申请的毒理试验,预计在今年年底之前递交IND申请。
结语
一项突破性的发现,哪怕带着诺贝尔奖的光环,也未必能够带来一款创新疗法。RNAi疗法开发的历史表明,科学发现从实验室出发,到来到患者身边,往往会经历漫长的研发之旅。HIF抑制剂的开发虽然产生了多款获得专利的化合物,但是能够进入临床开发的在研疗法寥寥无几。Arrowhead公司的多款在研疗法还要经过多重临床试验验证它们的疗效和安全性。
然而,也正是由于科学家们不懈的努力,才能破荆斩棘,开辟出一条造福患者的道路。我们期待RNAi疗法在获得了最初的突破之后,能够为更多患者造福。也希望新近获得诺奖的HIF信号通路,能够为患者带来创新疗法。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。