TCR双特异性蛋白获FDA突破性疗法认定
来源:医药魔方 2021-02-23 09:37
英国生物技术公司Immunocore宣布FDA授予其新型双特异性蛋白tebentafusp(IMCgp100)突破性疗法资格,用于治疗HLA-A*02:01阳性的不可手术切除或转移性成人葡萄膜黑色素瘤(mUM)患者。Tebentafusp是Immunocore公司采用其专有的ImmTAC技术平台开发的一种新型双特异性蛋白,将可溶性T细
英国生物技术公司Immunocore宣布FDA授予其新型双特异性蛋白tebentafusp(IMCgp100)突破性疗法资格,用于治疗HLA-A*02:01阳性的不可手术切除或转移性成人葡萄膜黑色素瘤(mUM)患者。
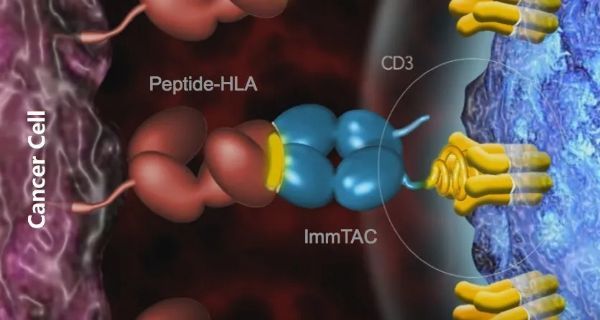
Tebentafusp是Immunocore公司采用其专有的ImmTAC技术平台开发的一种新型双特异性蛋白,将可溶性T细胞受体融合到anti-CD3抗体的免疫效应结构域,可以特异性靶向黑素细胞和黑素瘤抗原gp100一种在黑色素细胞和黑色素瘤中表达的谱系抗原)。Tebentafusp是ImmTAC技术平台诞生的第一个分子,目前已经推进至III期阶段。
具体而言,天然免疫系统会清除一些高亲和力的T细胞,以减轻自身免疫性疾病的风险。由于癌细胞可以伪装成正常“自身”细胞,并且只表达少量的HLA肽,因此需要高亲和力的TCR来识别它们。ImmTAC?技术平台开发的可溶性TCR成分将亲和力提高了几百万倍(μM~pM),克服了天然免疫系统的局限性,同时通过掺入埋在TCR核心内的新型链间二硫键而保持一种可溶但稳定的状态。
ImmTAC分子通过柔性接头将可溶性的TCR与抗CD3抗体的scFv片段融合,一端可以有效靶向pHLA复合物表达水平低至5-10 的肿瘤靶细胞,另一端则募集和激活T细胞,发挥消灭肿瘤细胞的作用。
葡萄膜黑色素瘤是一种罕见的侵袭性黑色素瘤,会影响眼睛。转移性葡萄膜黑色素瘤通常预后较差,目前尚无最佳治疗或治疗方法。尽管它是成人中最常见的原发性眼内恶性肿瘤,但确诊病例罕见,每年全球约有8,000名新确诊患者,美国每年为1600-2000例。葡萄膜黑色素瘤患者中多达50%最终会发展成转移性疾病。当癌症扩散到眼睛之外时,只有大约一半的患者可以存活一年。当期已经证明葡萄膜黑色素瘤对其他免疫疗法治疗不敏感。
一项在既往未经治疗的转移性葡萄膜黑色素瘤患者中进行的随机、III期临床研究(IMCgp100-202)的预定中期分析初步结果显示,在意向治疗人群中,tebentafusp作为单药疗法证明了更优的生存获益,相比研究者选择的治疗方法(帕博利珠单抗、伊匹木单抗、达卡巴嗪)显着提高了1年生存率(73% vs 58%),降低了49%的死亡风险(HR = 0.51,95%CI:0.36,0.71)。这是TCR疗法的首次证明总生存期获益,也是双特异性药物第一次在实体瘤中证明可以延长总生存期。
Tebentafusp还被FDA授予过治疗葡萄膜黑色素瘤的快速通道和孤儿药资格,Immunocore计划在2021Q3提交上市申请。如果获得批准,Immunocore相信tebentafusp将是40年来治疗转移性葡萄膜黑色素瘤的第一种新疗法。
基于已被证明的T细胞可以浸润肿瘤的机制,ImmTAC分子具有治疗血液肿瘤和实体瘤的潜力。除了Tebentafusp之外,Immunocore公司基于TCR平台布局开发了多款治疗药物,也赢得了罗氏、GSK巨头的青睐和合作。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。