儿科新药!美国FDA批准诺华Cosentyx(苏金单抗):治疗附着点炎相关关节炎(ERA)和幼年银屑病关节炎(JPsA)!
来源:本站原创 2021-12-25 00:41
截至目前,Cosentyx已获批5个适应症,该药是第一个治疗ERA的生物制剂、也是唯一一个可同时用于治疗ERA和PsA儿科患者的生物制剂。
附着点炎相关关节炎-ERA(图片来源:aboutkidshealth.ca)
2021年12月24日讯 /生物谷BIOON/ --诺华(Novartis)近日宣布,美国食品和药物管理局(FDA)已批准抗炎药Cosentyx(中文商品名:可善挺,通用名:secukinumab,司库奇尤单抗,俗称“苏金单抗”):(1)用于治疗4岁及以上活动性附着点炎相关关节炎(ERA)患者;(2)用于治疗2岁及以上活动性幼年银屑病关节炎(JPsA)患者。来自3期JUNIPERA研究的数据显示,在ERA和JPsA儿科患者中,治疗2年期间,与安慰剂相比,Cosentyx降低了疾病发作风险,并改善了疾病活动度,安全性与该药已知的安全性特征一致。
值得一提的是,Cosentyx是美国FDA批准的第一个治疗ERA的生物制剂、也是唯一一个被批准可同时用于ERA(4岁及以上)和PsA(2岁及以上)儿科患者的生物制剂。此次是Cosentyx在美国儿科人群中获得的第二项、第三项批准。目前,Cosentyx在风湿病和皮肤病方面共获批5个适应症。
ERA和JPsA是幼年特发性关节炎(JIA)的亚型,属于自身免疫性疾病。ERA的特征是关节肿胀和疼痛,肌腱和韧带附着在骨骼上,在触诊髋部时可能出现腰痛或压痛。JPsA以关节肿胀和皮肤银屑病为特征,在一级亲属(first-degree relative,FDR)中可能出现指甲改变、手指和/或脚趾炎症或银屑病皮肤改变。如果不进行治疗,ERA和JPsA会导致高度疼痛和致残。
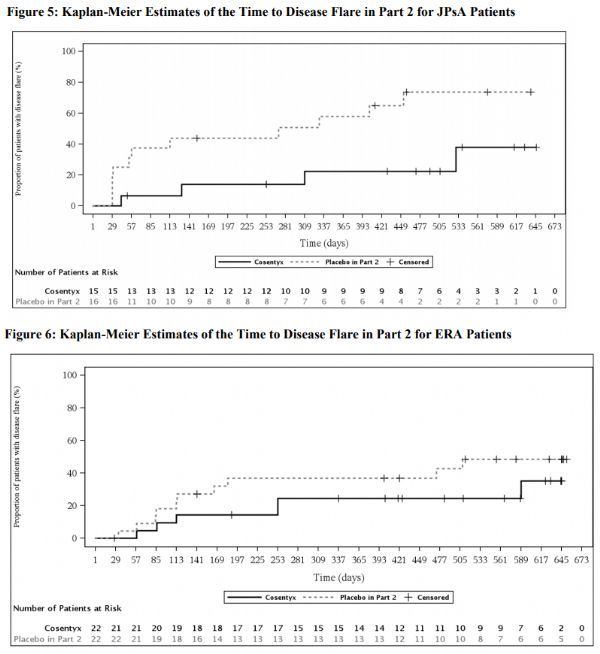
此次批准,基于3期JUNIPERA研究的数据。该研究为期2年,分三部分,双盲、安慰剂对照、随机撤药试验,入组了86名2-18岁的ERA或JPsA儿童和青少年患者。研究的主要终点是在治疗期2(第12周至第104周)的发作时间。
结果显示,与安慰剂相比,接受Cosentyx治疗的活动性JPsA患者(n=34;平均年龄12.2岁)发作时间显著延迟,发作风险降低85%(p<0.001)。研究还表明,接受Cosentyx治疗的活动性ERA患者(n=52;平均年龄13.7岁)的发作时间显著延迟,发作风险降低53%。该儿科人群中Cosentyx的安全性与该药治疗斑块型银屑病(PsO)、PsA、非放射学中轴型脊柱关节炎(nr-axSpA)、强直性脊柱炎(AS)的安全性相一致。
JUNIPERA研究结果
辛辛那提儿童医院医学博士Hermine Brunner评价称:“之前的研究表明,尽管接受了治疗,一些患有PsA或ERA的儿童和青少年仍会继续出现症状。3期JUNIPERA试验的结果表明,在整个治疗期间,使用Cosentyx治疗的儿童患者表现出明显的缓解。这一批准对于一些仍在与关节炎症、手指和脚趾肿胀等疼痛症状作斗争的儿科患者来说是个大好消息。”
Cosentyx是首个特异性靶向抑制白介素-17A(IL-17A)的全人单克隆抗体药物,能够选择性靶向阻断循环IL-17A的活性,降低免疫系统的活动并改善疾病症状。研究揭示,IL-17A在驱动机体在多种自身免疫性疾病的免疫应答中发挥了重要作用,包括银屑病关节炎(PsA)、斑块型银屑病(PsO)、强直性脊柱炎(AS)、放射学阴性中轴型脊柱关节炎(nr-axSpA)。
Cosentyx于2015年1月获批上市,目前已获批5个适应症(PsO[≥6岁]、PsA[≥2岁]、AS[≥18岁]、nr-axSpA[≥18岁]、ERA[≥4岁])。Cosentyx拥有强有力的临床证据支持,包括支持该药治疗前三大适应症(PsO、PsA、AS)长期安全性和有效性的5年成人临床数据。这些数据加强了Cosentyx在横跨AS、axSpA、PsA、PsO中的治疗地位。自2015年上市以来,全球已有超过50万例患者接受了Cosentyx治疗。
今年8月,中国国家药品监督管理局(NMPA)批准Cosentyx:用于治疗年龄≥6岁、体重≥50公斤、适合接受系统治疗或光疗的中度至重度斑块型银屑病(PsO)儿童和青少年患者。在中国,Cosentyx分别于2019年3月、2020年4月获得批准,用于治疗成人中重度斑块状银屑病(PsO)和成人强直性脊柱炎(AS)。
值得一提的是,Cosentyx是中国第一个获批用于治疗儿童和青少年银屑病的白介素类抑制剂。该批准基于评估Cosentyx治疗6岁至18岁以下儿童和青少年中重度斑块状银屑病患者的2项国际3期研究。这些研究报告的安全性与成人中重度斑块型银屑病试验报告的安全性一致,未观察到新的安全信号。
随着此次批准,Cosentyx将为中国的银屑病儿童和青少年群体提供一种一线系统疗法。截至目前,Cosentyx已在包括美国和欧盟国家在内的多个国家和地区获批5个适应症,诺华计划在未来十年内扩大至10个适应症。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->