1型糖尿病(T1D)重大进展!美国FDA批准Tzield:首个可延缓1型糖尿病发病的药物!
来源:生物谷原创 2022-11-22 10:13
Tzield(teplizumab)是第一种可预防/延缓高危人群发展为临床1型糖尿病(T1D)的疗法。2周疗程治疗将疾病风险降低50%、发病推迟25个月(2年)。

2022年11月17日讯 /生物谷BIOON/ --Provention Bio是一家致力于拦截和预防免疫介导性疾病的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Tzield(teplizumab-mzwv)注射液:该药是一种静脉注射的抗CD3单抗,作为第一种也是唯一一种免疫调节疗法,用于目前患有2期1型糖尿病(T1D)的成人和儿童患者(≥8岁),延缓3期T1D(临床T1D)的发病。用药方面,Tzield连续14天每天静脉输注一次。
值得一提的是,Tzield是第一种可预防/延缓特定人群发展为临床T1D(3期T1D)的疗法,这是继一个世纪前胰岛素问世以来,T1D治疗方面取得的第一个重大进展。来自关键性TN-10研究数据显示,在病程处于2期的T1D症状前患者中,与安慰剂相比,单个为期2周(14天)疗程的Tzield治疗,将胰岛素依赖性临床期疾病(3期T1D)的中位诊断时间延迟了25个月或约2年(50个月 vs 25个月),这代表着3期T1D发病时间在统计学上显著延长。
Tzield是用于T1D的第一种疾病修正疗法。T1D是一种危及生命的自身免疫性疾病。2期T1D定义为存在2种或多种T1D相关自身抗体和血糖代谢障碍。3期T1D的发病是一个改变生命的时刻,进展至3期T1D的患者,最终需要终生注射胰岛素。3期T1D与严重的健康风险相关,包括危及生命的糖尿病酮症酸中毒。
Tzield通过优先审查程序获得批准,之前已被授予突破性疗法认定(BTD)。目前,Tzield也正在接受欧洲药品管理局(EMA)的审查。在欧盟,Tzield之前被授予了优先药物资格(PRIME)。PRIME是EMA推出的一个快速审批项目,与美国FDA的BTD项目相似,旨在加速医药短缺领域重点药品的审评进程。
FDA药物评估与研究中心糖尿病、血脂紊乱和肥胖部主任John Sharretts表示:“今天批准的首创(first-in-class)疗法为某些高危T1D患者带来了一个重要的新治疗选择。该药延迟1型糖尿病(T1D)临床诊断的潜力,可能会为患者提供数月至数年的无疾病负担。”
2022年10月,Provention Bio宣布与赛诺菲就美国推出Tzield达成联合推广协议,以延缓高危人群临床T1D的发病。赛诺菲美国全科医学主管Olivier Bogillot表示:“这一批准对糖尿病界来说是一个意义深远且期待已久的胜利。我们赞扬Proventio Bio坚定不移的决心,为患者带来了有史以来第一种T1D疾病修正疗法。我们期待利用赛诺菲在内分泌学方面建立的基础设施和专业知识,为美国各地有需要的患者提供服务。”
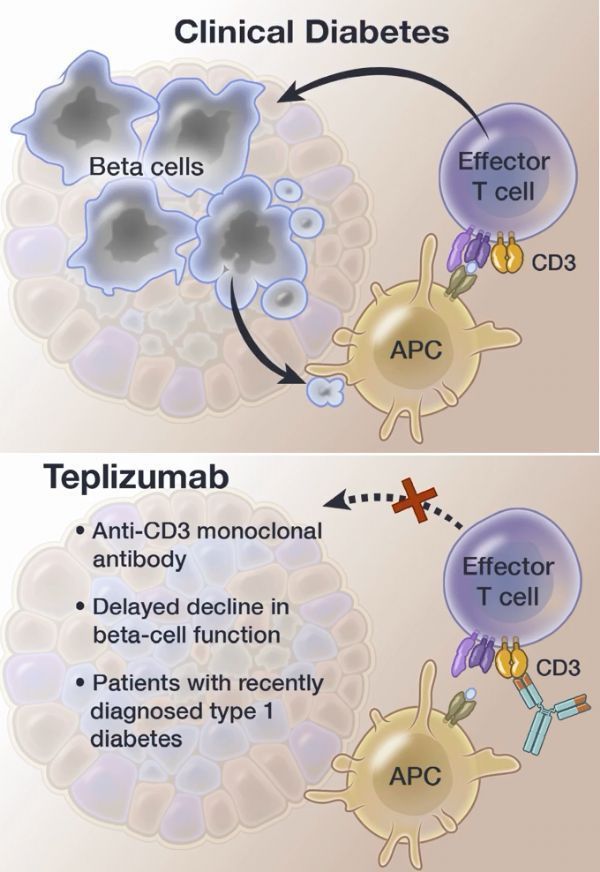
teplizumab作用机制
1型糖尿病(T1D)是一种当免疫系统攻击并破坏产生胰岛素的细胞时发生的疾病。被诊断为T1D的患者血糖升高,需要注射胰岛素(或佩戴胰岛素泵)才能生存,并且必须全天定期检查血糖水平。尽管T1D可以在任何年龄出现,但通常在儿童和年轻人中被诊断。尽管大多数T1D患者没有家族病史,但如果父母、兄弟或姐妹患有T1D,则发生T1D的风险较高。
Tzield(teplizumab)是一种抗CD3单克隆抗体,开发用于拦截和预防临床T1D。Tzield与特定的免疫系统细胞结合,并延缓进展至3期T1D。Tzield可以使攻击胰岛素产生细胞的免疫细胞失活,同时增加有助于调节免疫反应的细胞比例。
Tzield已在多项临床研究中进行了评估,涉及超过1000例患者,其中超过800例患者接受了Tzield治疗。此前在新诊患者中开展的研究显示,teplizumab持续证明了其保持β细胞功能和减少外源性胰岛素使用的能力。
此次批准基于TrialNet开展的TN-10研究(“At-Risk”,NCT01030861)的临床数据。这是一项关键性随机、双盲、事件驱动、安慰剂对照临床试验,评估了teplizumab在2期T1D患者中延缓发生3期T1D的疗效和安全性。结果显示,与安慰剂相比,单个为期2周(14天)疗程的teplizumab治疗显著推迟了高危儿童和成人临床T1D的发病和诊断时间,T1D发病率降低50%,发病中位时间推迟25个月或约2年。
这些数据清楚地显示,短期免疫治疗可以显著延缓T1D的临床发生,开发不需要连续治疗以影响自身免疫性疾病的免疫调节药物将是一个重大的模式转变。根据TN-10研究,teplizumab是第一个可显著延迟T1D临床发病的免疫调节剂,有望干预并从根本上改变高危群体的T1D进展。
除了评估teplizumab用于T1D患者亲属中具有高风险个体预防T1D的潜力之外,Provention Bio公司也正在评估teplizumab用于新诊断为胰岛素依赖性T1D患者的疗效(III期PROTECT研究)。
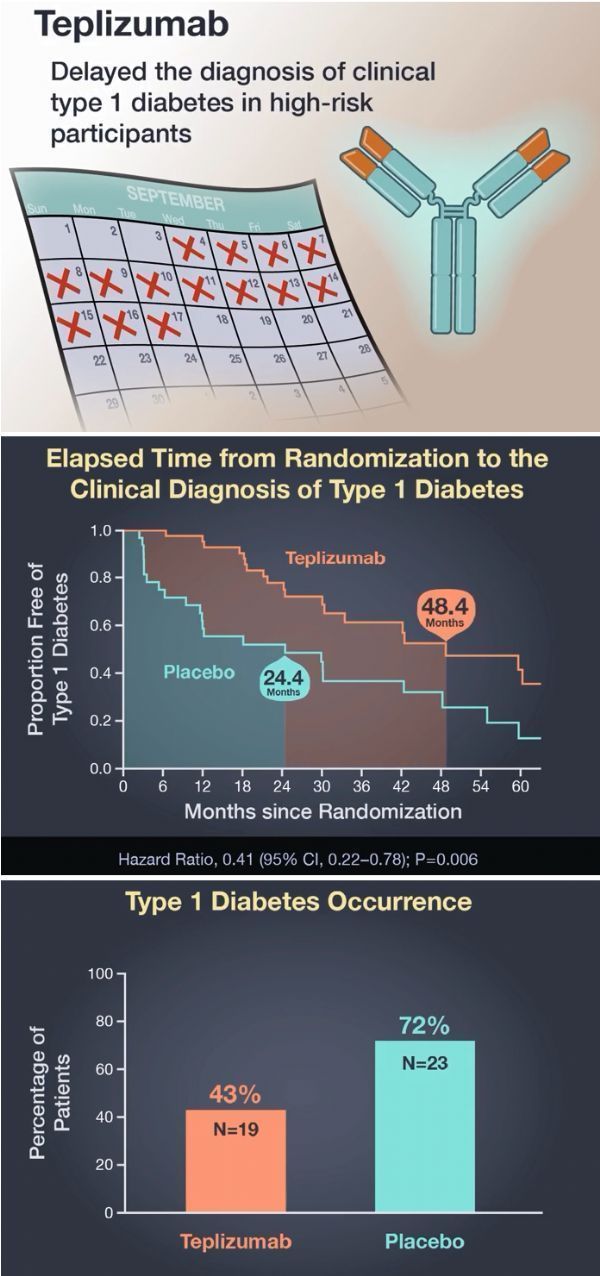
teplizumab临床试验数据(图片来源于:NEJM)
TN-10研究共入组了76例年龄8-49岁的2期T1D受试者,这些受试者是1型糖尿病患者的亲属、存在2种或多种T1D自身抗体和异常的葡萄糖代谢(血糖异常)、没有糖尿病、但有很高的风险发展为糖尿病临床疾病。72%的受试者年龄在18岁以下。研究中,这些受试者随机接受teplizumab或安慰剂治疗。
研究结果已发表于国际医学期刊《新英格兰医学杂志》(NEJM),文章标题为:An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes。数据表明,在高危(2期T1D)儿童和成人中,与安慰剂相比,单个14天疗程teplizumab治疗显著延迟了临床T1D(3期T1D)的发病和诊断,延迟的中位时间为2年。具体为,安慰剂组受试者临床诊断T1D的中位时间为25个月,相比之下,teplizumab组受试者临床诊断T1D的中位时间为50个月(HR=0.41;95%CI:0.22-0.78;p=0.0066)。在研究期间,安慰剂组有72%的患者出现临床糖尿病,teplizumab组仅为45%。研究中,teplizumab的耐受性良好,安全性数据与先前对新诊患者的研究一致。
这项具有里程碑意义的突破性研究表明,可以使用免疫疗法,特别是teplizumab,来预防或显著延缓临床1型糖尿病发作至少2年时间。更重要的是,研究中约60%的受试者在一个疗程的teplizumab治疗后没有出现T1D,比例是安慰剂组的2倍。
teplizumab是第一个显示可延迟T1D临床发病的免疫调节剂。其临床结果对于有患1型糖尿病风险的个人,如患者家属,具有真正的临床意义。延迟临床T1D的发病可能意味着疾病负担可能会推迟到患者能够更好地管理其疾病的时间,例如婴儿期、小学、高中甚至大学之后。teplizumab上市后,临床医生将可以干预并从根本上改变这些高危受试者的T1D进展。(生物谷Bioon.com)
原文出处:FDA Approves First Drug That Can Delay Onset of Type 1 Diabetes
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


