Nature:重大进展!我国科学家开发出非病毒的基因特异性靶向CAR-T细胞,并在临床试验中证实它们可安全有效地治疗复发/难治性B细胞非霍奇金淋巴瘤
来源:生物谷原创 2022-09-28 07:00
来自中国浙江大学和华东师范大学等研究机构的研究人员利用CRISPR-Cas9开发出非病毒的、基因特异性靶向CAR-T细胞,在临床前实验和临床试验中可安全高效地杀死肿瘤细胞。
近年来,嵌合抗原受体(CAR)T细胞(CAR-T)疗法迅速发展,它在癌症治疗中显示出巨大的潜力。然而,一些局限性仍然存在,包括目前的CAR-T细胞疗法的复杂制造过程、高生产成本、较长的制备时间和潜在的安全问题。在CAR-T细胞生产中使用病毒是一个令人担忧的领域,因为这种方法的缺点包括插入突变导致的肿瘤产生风险增加。此外,对病毒DNA的特异性反应往往会阻碍CAR的表达,而且病毒制备本身经常会产生高额费用。尽管一些不使用病毒的策略,如使用转座子系统和mRNA转导,正在用来产生CAR-T细胞,但随机整合和CAR表达中断导致的CAR-T细胞同质性较低成为额外的问题。近期,一些研究表明,通过使用腺相关病毒(AAV)载体作为模板,可以应用基因组编辑技术来产生基因座特异性整合的CAR-T细胞。此外,有人提出了一种优选的非病毒策略,以产生可校正点突变和精确插入T细胞受体(TCR)的T细胞产品。

为了同时解决病毒使用和随机整合的缺点,来自中国浙江大学和华东师范大学等研究机构的研究人员利用CRISPR-Cas9开发出非病毒的、基因特异性靶向CAR-T细胞,并一项1期开放标签的单臂临床试验中证实它们在治疗8名复发/难治性B细胞非霍奇金淋巴瘤(relapsed/refractory B cell non-Hodgkin lymphoma, r/r B-NHL)患者中的高安全性和有效性。相关研究结果近期发表在Nature期刊上,论文标题为“Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL”。
据这些作者的说法,他们是世界上首次在临床试验中证实非病毒的、基因特异性靶向CAR-T细胞的安全性和有效性的。通过使用非病毒的、将靶向CD19的CAR整合到PD1基因中的CAR-T细胞(PD1-19bbz CAR-T细胞),他们发现接受这些CAR-T细胞治疗的r/r B-NHL患者具有显著的安全性,只有较低的轻度细胞因子释放综合征(CRS)发生率,并且没有发生神经系统毒性。他们的临床前实验也表明不论肿瘤细胞是否较高地表达PD-L1,PD1-19bbz CAR-T细胞都能高效地清除它们。这些研究结果也与之前报道的两项临床试验一致,因而进一步证实了CRISPR-Cas9应用于T细胞治疗的安全性。与此同时,他们观察到较高的完全缓解率和持久的完全缓解。特别是在两名PD-L1高表达的r/r B-NHL患者中发现了反应(尽管后来一名患者发生了CD19-肿瘤复发)。令人惊讶的是,尽管初始的PD1-19bbz CAR-T细胞剂量(没公斤体重输注2×106个细胞)出乎意料地低,或者由于早期和仍然不成熟的制造过程导致CAR+细胞的比例很低,但是在12个月的中位观察期间,8名患者中有7人实现了完全缓解,这表明这些PD1-19bbz CAR-T细胞具有更强的杀死肿瘤细胞的效力。
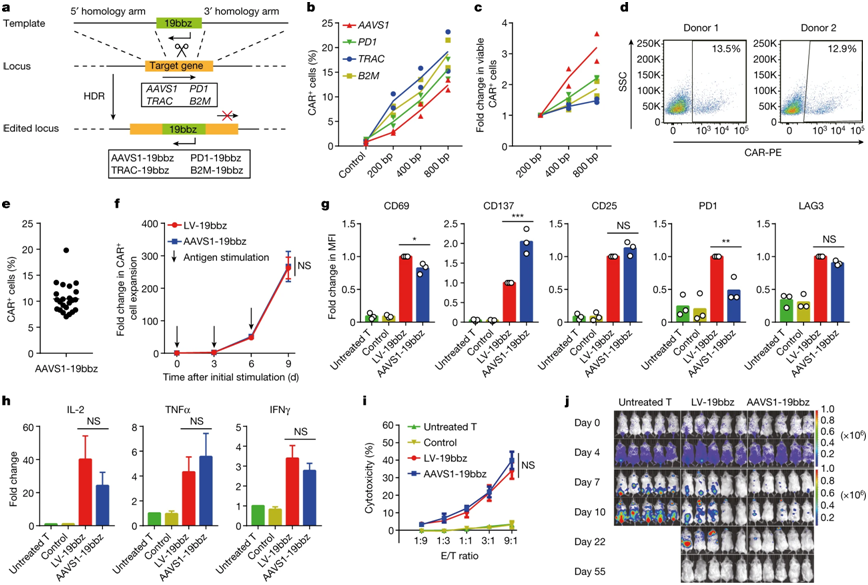
非病毒的将CAR整合到AAVS1基因中的CAR-T细胞有效消除肿瘤细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-05140-y。
这些作者的临床前和临床数据表明,PD1-19bbz CAR-T细胞对肿瘤细胞有较高的杀伤效果,这可以用两个特点来解释。首先,单细胞RNA测序(scRNA-seq)数据显示,在PD1-19bbz CAR-T细胞中存在高比例的记忆T细胞。第二,基因集合富集分析结果表明,将靶向CD19的CAR整合到PD1基因中实现的PD1破坏使得PD1-19bbz CAR-T细胞具有增强的抗肿瘤功能。在小鼠模型中发现,与将靶向CD19的CAR整合到AAVS1基因中的CAR-T细胞相比,PD1-19bbz CAR-T细胞更有力地消除了肿瘤细胞,从而验证了这种优势。值得注意的是,这种优势甚至在PD-L1低表达的肿瘤细胞中也被观察到。此外,鉴于除PD1之外的其他抑制性受体(比如LAG3、TIM3和TIGIT)在临床输注后仍在PD1-19bbz CAR-T细胞中高度表达,同时对多种抑制途径进行干预有望进一步增强CAR-T细胞的功能。
综上所述,这些作者描述了一种通过CRISPR-Cas9开发非病毒的基因特异性靶向CAR-T细胞的新策略。这项技术之所以先进,是因为结合了非病毒制造工艺和精确基因组编辑的优势。作为一种不使用病毒的二合一方法,CAR-T细胞的制造程序得到简化,缩短了制备时间,减少了生产费用,提高了CAR-T细胞产品的安全性和有效性。这些优势非常重要,特别是对于制造经过基因修饰的CAR-T细胞来说,通常需要同时进行病毒制备和基因组编辑过程。此外,基因座特异性整合增强了CAR-T细胞的同质性,使得它们有可能利用多功能的细胞产品。重要的是,他们展示了这种技术从实验室到临床的可行应用,并在临床试验中证实了它的高度安全性和有效性。因此,他们提出了一种创新的突破目前的障碍的CAR-T细胞技术,并展示了CRISPR-Cas9介导的非病毒、基因特异性靶向技术在细胞治疗中的巨大潜力。(生物谷 Bioon.com)
参考资料:
Jiqin Zhang et al. Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL. Nature, 2022, doi:10.1038/s41586-022-05140-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


