梳理心脏再生研究进展
来源:本站原创 2021-09-30 23:45
2021年9月30日讯/生物谷BIOON/---在心脏病发作后,死亡的心肌组织会由瘢痕组织替代。不过,瘢痕组织与心肌的搏动方式不相同,因而心脏的“泵血”能力下降。近年来,科学家们采用多种手段将心脏瘢痕组织和其他组织中的成纤维细胞直接重编程为心肌细胞。这一突破性的成果为未来的临床试验和心脏病患者治疗奠定基础。基于此,小编针对这一方面的最新进展,进行一番盘点,以
2021年9月30日讯/生物谷BIOON/---在心脏病发作后,死亡的心肌组织会由瘢痕组织替代。不过,瘢痕组织与心肌的搏动方式不相同,因而心脏的“泵血”能力下降。近年来,科学家们采用多种手段将心脏瘢痕组织和其他组织中的成纤维细胞直接重编程为心肌细胞。这一突破性的成果为未来的临床试验和心脏病患者治疗奠定基础。基于此,小编针对这一方面的最新进展,进行一番盘点,以飨读者。
1.Science:重大进展!新方法让成年哺乳动物的心肌细胞恢复年轻状态,可使心脏具有再生能力
doi:10.1126/science.abg5159
现有研究表明,成年哺乳动物的心脏不包含心脏干细胞,而且绝大多数心肌细胞不会分裂。因此,在成年哺乳动物的心脏中,心肌细胞的替换非常缓慢,阻止了受损心肌的再生。心肌细胞的有丝分裂后的性质阻止了心脏肿瘤的形成,但同时也将心肌细胞的更新降到最低。相比之下,胎儿心脏显示出相当大的再生潜力,因为存在不太成熟的仍有增殖能力的心肌细胞。
在一项新的研究中,来自德国马克斯普朗克心肺研究所、哥廷根大学医学中心、德国心血管研究中心、马克斯普郎克分子生物医学研究所和加拿大曼尼托巴大学的研究人员发现有可能对心肌细胞进行重编程以修复受损的心肌组织。相关研究结果发表在2021年9月24日的Science期刊上,论文标题为“Reversible reprogramming of cardiomyocytes to a fetal state drives heart regeneration in mice”。在这篇论文中,这些作者描述了他们修复小鼠受损心脏的方法,以及在测试中效果如何。
图片来自Pixabay/CC0 Public Domain。
具体而言,他们发现Oct4、Sox2、Klf4和c-Myc(OSKM)的心脏特异性表达能诱导成年的心肌细胞去分化到类似于胎儿心肌细胞的多能性状态,从而赋予成年心肌细胞以再生能力而重新进入有丝分裂。OSKM的瞬时特异性表达延长了产后小鼠心脏的再生窗口期,并诱导成年心肌细胞的基因表达程序,从而使之类似于胎儿心肌细胞。延长OSKM在成年心肌细胞中的表达会导致心肌细胞重编程和心脏肿瘤的形成。在心肌梗塞前和心肌梗塞期间短期表达OSKM可以改善心肌损伤并提高心脏功能,这表明时间上控制的心肌细胞去分化和重编程可以使成年哺乳动物的心肌细胞重新进入有丝分裂,促进心脏再生。
2.Nat Commun:放射疗法竟将心肌细胞恢复到年轻状态
doi:10.1038/s41467-021-25730-0
在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员发现放射疗法可以将心肌细胞重新编程到似乎更年轻的状态,无需长期使用的侵入性手术,就能解决导致危及生命的心律失常的电信号问题。相关研究结果于2021年9月24日发表在Nature Communications期刊上,论文标题为“Cardiac radiotherapy induces electrical conduction reprogramming in the absence of transmural fibrosis”。
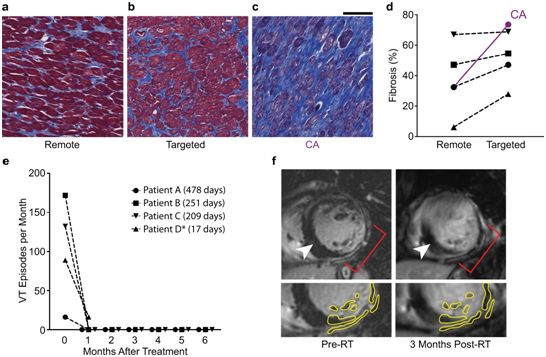
心肌纤维化本身并不能解释放射疗法后的室性心动过速下降的时间和影响。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-25730-0。
这些作者还发现,放射疗法的有益影响在存活的患者中至少持续了两年。重要的是,他们能够在小鼠身上证明较低剂量的放射产生同样的效果。较低的放射剂量可以最大限度地减少长期副作用,并为其他类型的心律失常打开这种治疗的大门。虽然Notch在这些效果中起着重要的作用,但Schwarz说它不是唯一涉及的信号通路。他们正在继续研究放射如何触发心脏细胞恢复到更健康的状态。
3.Cardiovasc Res:保守的长链非编码RNA CARMA调控心肌细胞分化
doi:10.1093/cvr/cvab281
从多能干细胞生产功能性心肌细胞需要严格控制分化过程。长链非编码rna (lncrna)在细胞发育过程中发挥重要的调控作用。在这项研究中,作者设计了一种综合方法来识别在分化人类胚胎干细胞(ESCs)中涉及心脏发生的lncRNAs。
本研究报道了心肌细胞成熟相关lncRNA (CARMA)的功能特征,这是一种以前被称为C20orf166-AS1的lncRNA。在分化胚胎干细胞(ESCs)中,CARMA敲低可促进人和小鼠的心源性承诺和心肌细胞分化。CARMA的表达与肌肉特异性miRNAs MIR-1-1、MIR-133a2的表达呈负相关。这两个mirna的前体以相反的方向紧挨着新识别的lncRNA,提供了CARMA作用机制,支持其在心肌细胞分化中的作用。
此外,作者发现NOTCH信号是通过MIR-133a2靶向NOTCH效应分子RBPJ来控制CARMA下游的,进一步支持CARMA在140心源性分化和成熟调控中的重要性。有趣的是,Notch在ESCs中的作用部分是通过调节两种lncrna的表达来进行的,这两种lncrna被称为神经外胚层规范的抑制因子。
4.Redox Biol:MLN4924对改善Sirt1所致心肌缺血-再灌注损伤的心肌保护作用
doi:10.1016/j.redox.2021.102114
泛素化修饰是心肌细胞在氧化应激状态下生存所必需的,它参与自噬调节。然而,去甲肾上腺素抑制剂MLN4924是否对心肌缺血/再灌注(MI/R)起到心脏保护作用尚不清楚。在本研究中,MLN4924具有很强的心脏保护作用,表现为显著提高细胞存活率,降低乳酸脱氢酶泄漏率,并改善体外H2O2诱导的细胞形态。与MI/R小鼠相比,MLN4924还能显著降低血清心肌酶谱水平,改善心脏组织病理学改变,减轻左室收缩功能障碍,从而限制在体心肌梗死范围。令人惊讶的是,MLN4924的这种作用被自噬通量抑制剂氯喹联合处理而被取消。总之,MLN4924在体外和MI/R小鼠中通过恢复H2O2诱导的损伤的自噬通量而显示出强大的心脏保护作用。
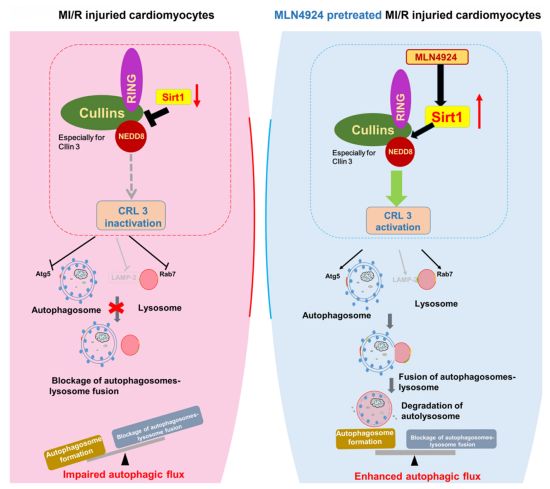
本项目总结了MLN4924通过Sirt1增强心肌细胞自噬通量对抗MI/R损伤的潜在机制。图片来源:https://doi.org/10.1016/j.redox.2021.102114。
5.Nat Commun:新型成像技术或能预测干细胞分化为心肌细胞的方式和效率
doi:10.1038/s41467-021-24868-1
人类多能干细胞(hPSC)衍生的心肌细胞能为心血管疾病患者提供一种非常有希望的再生细胞疗法,同时其还能作为加速药物开发的重要模型系统;然而研究人员必须开发具有成本效益和时间效益的平台来评估hPSC衍生的心肌细胞在生物制造过程中的质量。干细胞研究在再生疗法和防治用于抵御心血管疾病上拥有巨大的潜力,目前心血管疾病引发的死亡在全球占到了30%以上的比例。
高功能的心肌细胞(负责心脏的收缩)在很多领域都非常重要,比如疾病建模、药物筛选及其它再生医学疗法的开发中。然而干细胞分化为心肌细胞的过程也较为昂贵,且易于发生变化。目前研究人员需要对干细胞分化过程进行质量控制,从而用于扩大工业上的应用规模。近日,一篇发表在国际杂志Nature Communications上题为“Label-free imaging for quality control of cardiomyocyte differentiation”的研究报告中,来自Morgridge研究所等机构的科学家们通过研究开发了一种能预测心肌细胞分化效率的无创成像技术,其或能作为质量控制的手段。
研究者Tongcheng Qian说道,如果我们能够尽可能早地预测干细胞分化为心肌细胞的结果,我们就能在制造阶段节省时间、金钱和速度。人类诱导多能干细胞分化为心肌细胞大概需要14天时间,在此期间,细胞的代谢活性会发生巨大的变化。文章中,研究人员在整个干细胞分化过程中的不同时间点测定了两种参与细胞代谢的分子NAD(P)H和FAD的自发荧光,由于这种方法使用了细胞固有的自发荧光,且其是非侵入性的,能在不损害细胞的情况下实时进行。
6.Stem Cell Rep:三个关键基因组成的基因网络或能决定心脏细胞的生长
doi:10.1016/j.stemcr.2021.06.014
Hand1和Hand2是两种特殊的转录因子,编码这两种转录因子的基因被敲除后会使得小鼠分别表现为左心室和右心室发育不良。长期以来,心脏疾病一直是引发全球人群死亡的主要原因,其中原因之一就是心脏的再生能力较差,从而就会导致损伤积累;科学家们推测,理解心脏如何从胚胎开始或有望帮助开发出新型疗法。近日,一篇发表在国际杂志Stem Cell Reports上题为“Expression dynamics of HAND1/2 in in vitro human cardiomyocyte differentiation”的研究报告中,来自京都大学等机构的科学家们通过研究为了模拟心脏细胞的发育,他们利用人类诱导多能干细胞进行研究揭示了三种基因的重要性,即HAND1, HAND2和LEF1三个基因。
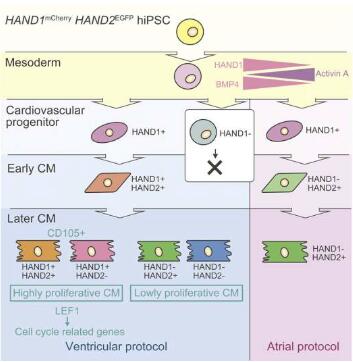
三个关键基因或能决定心脏细胞的生长。图片来源:Chikako Okubo,et al. Stem Cell Reports (2021). DOI:10.1016/j.stemcr.2021.06.014。
而应用相关研究手段或步骤,研究人员发现,HAND1基因对于诱导多能干细胞所产生的心肌细胞的功能至关重要;研究者发现了HAND1, HAND2和LEF1这三个基因所组成的一个基因网络,其或能控制心肌细胞的增殖;而LEF1基因则主要涉及细胞生长和癌症的发生。研究者Okubo及其同事还发现,这三个基因的影响效应或许来自于其之间的直接相互作用力。
7.Circulation:治疗性抑制ASIC1a可恢复缺血-再灌注损伤后的心脏功能
doi:10.1161/CIRCULATIONAHA.121.054360
缺血-再灌注损伤(ischemia-reperfusion injury, IRI)是与心血管疾病相关的发病率和死亡率有关的主要风险因素之一。在心脏缺血期间,酸性代谢物的堆积导致细胞内和细胞外的pH值下降,可低至6.0~6.5。由此产生的组织酸中毒加剧了缺血性损伤,并显著影响心脏功能。
在一项新的研究中,来自澳大利亚昆士兰大学和新南威尔士大学的研究人员使用遗传和药物学方法,在细胞和整个器官水平上研究酸敏感离子通道1a(acid sensing ion channel 1a, ASIC1a)在心脏缺血-再灌注损伤中的作用。他们使用人诱导性多能干细胞衍生的心肌细胞(hipsC-CM)以及缺血-再灌注损伤的体外和体内模型来测试ASIC1a抑制剂作为处理前和处理后治疗剂的功效。相关研究结果于2021年7月15日在线发表在Circulation期刊上,论文标题为“Therapeutic Inhibition of Acid Sensing Ion Channel 1a Recovers Heart Function After Ischemia-Reperfusion Injury”。
对人类复杂性状遗传学的分析表明,ASIC1基因座位的变异与心脑血管缺血性损伤明显相关。通过利用体外的hipsC-CM和小鼠体外心脏模型,这些作者证明ASIC1a基因消融可以改善急性缺血-再灌注损伤后心肌细胞的生存能力。使用特异性的强效药物抑制剂对ASIC1a进行治疗性阻断,可以重现这种心脏保护作用。
8.Nature:基因MEOX1控制心脏中的成纤维细胞激活,阻止它有望预防心脏纤维化
doi:10.1038/s41586-021-03674-1
健康的心脏是一种柔韧的、不断活动的器官。但在因损伤、心血管疾病或衰老引起的应激下,心脏会在一种称为纤维化的过程中变厚和变硬,这涉及到弥漫的疤痕状组织形成。长期以来,减缓或阻止纤维化以治疗和预防心力衰竭一直是心脏病专家的目标。
如今,在一项新的研究中,来自美国格拉德斯通研究所的研究人员发现心脏纤维化的一个主控开关。他们发现,当心脏处于应激时,成纤维细胞中的基因MEOX1被开启,从而刺激纤维化。这一发现表明,阻断这一基因可能能够防止心脏和随着时间的推移也会因为硬化而功能衰竭的其他器官中的纤维化。相关研究结果近期发表在Nature期刊上,论文标题为“A transcriptional switch governs fibroblast activation in heart disease”。

间歇暴露于BET溴域抑制期间,心力衰竭中非心肌细胞的单细胞转录景观,图片来自Nature, 2021, doi:10.1038/s41586-021-03674-1。
虽然这些作者没有发现心肌细胞有明显的变化,但他们观察到这种治疗在心脏成纤维细胞中诱发了惊人的变化。心脏成纤维细胞占人类心脏细胞的一半以上。特别是,他们发现,基因MEOX1在心力衰竭的小鼠中高度活跃,当这些小鼠接受BET抑制剂治疗时,其水平急剧下降。此外,MEOX1的水平与成纤维细胞的激活相关;当该基因被开启时,这些成纤维细胞更擅长制造疤痕组织。事实上,MEOX1似乎是成纤维细胞激活的一个“主调控因子”,控制着数以千计个其他有助于纤维化的基因。
9.ACS Nano:一种微创外泌体喷雾剂修复心肌梗死后心脏
doi:10.1021/acsnano.1c00628
心肌梗死(MI)仍然是世界范围内最常见的死亡原因。许多心肌梗死幸存者将遭受复发性心力衰竭(Hf)的折磨,这已被认为是不良预后的决定因素。尽管直接经皮冠状动脉介入治疗成功地改善了心肌梗死后早期存活率,但心肌梗死后心力衰竭正成为晚期发病率、死亡率和医疗费用的主要驱动因素。在过去的十年里,再生医学的发展给心肌梗死的治疗带来了希望。间充质干细胞(mesenchymal stem cell,MSC)来源的外泌体是心脏再生干细胞旁分泌因子的重要组成部分。然而,它的再生能力受到心脏递送效率低的阻碍。作者设计、制造并测试了一种基于MSC外泌体和生物材料的微创外泌体喷雾剂(EXOS)。在急性心肌梗死的小鼠模型中,EXOS改善了心功能,减少了纤维化,并促进了损伤后心脏的内源性血管肌肉生成。作者进一步在猪模型上测试了EXOS的可行性和安全性。结果表明,EXOS是一种很有前途的策略,可以用来运送心脏修复的治疗性外泌体。
在这项研究中,作者设计并测试了一种微创外泌体喷雾剂(EXOS),方法是在FDA批准的纤维蛋白支架中种植msc衍生的外泌体。这种复合材料不仅有效地保存了MSC衍生的外泌体在心脏上,而且还避免了开胸手术造成的大的外科创伤。作者对EXOS的结构和体外再生能力进行了表征,证实了EXOS在小鼠心肌梗死模型上的治疗效果,并进一步验证了EXOS治疗大鼠和猪的可行性。
10.Nature:关闭关键心脏蛋白MARK4或有望帮助保护机体抵御心力衰竭和心脏病发作
doi:10.1038/s41586-021-03573-5
心肌梗死(myocardial infarction)是成年人过早死亡的一个主要原因,心肌梗死后心脏功能受损会导致机体出现慢性心力衰竭,同时还会伴随有全身性的健康并发症以及较高的死亡率。为此研究人员就需要开发出有效的治疗性策略来改善心肌梗死后心脏功能的恢复;更具体地来讲,研究者急需开发出一类新药来改善患者机体心脏心肌细胞的收缩能力,因为当前可用的影响肌肉收缩的疗法往往与收缩性心力衰竭患者较高的发病率和死亡率有关,或者对心力衰竭风险的降低非常有限;微管的去酪氨酸化(detyrosination,即移除酪氨酸化学基团)如今就成为了调节心肌细胞收缩的重要机制。
近日,一篇发表在国际杂志Nature上题为“MARK4 controls ischaemic heart failure through microtubule detyrosination”的研究报告中,来自剑桥大学等机构的科学家们通过研究发现,关闭一种关键的心肌蛋白或能为药物提供一种新方法来帮助抵御心脏病患者发生心力衰竭。寻找心脏病发作心脏损伤后能成功改善心脏泵血能力的药物是科学家们目前一直迫切研究的方向,然而,很多能让衰竭的心肌强烈收缩的药物都被认为是不安全的,于是这就给开发治疗心脏病发作和心力衰竭的新型疗法留下了一定的机会和研究空白,如今研究人员识别出了一种新型的药物靶点,即名为MARK4的特殊蛋白。
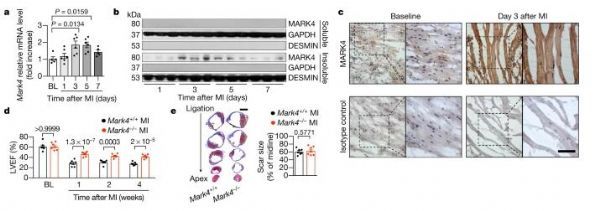
MARK4的缺失能保留心肌梗死后机体的心脏功能,同时并不会改变疤痕的尺寸。图片来源:Yu, X., et al. Nature (2021). doi:10.1038/s41586-021-03573-5。
这篇研究报告中,研究人员首次发现,MARK4能微调心肌细胞中名为微管网络的结构网络,微管网络能吸附于促进心肌细胞收缩和放松的“机器”上;当心脏病发作后MARK4的水平上升时,微管就会被紧紧锚定到心脏中的收缩“机器”上,从而引发更多的阻力并抑制其正常发挥功能;而当MARK4的水平降低时,微管则会被松散地固定住,从而使得心脏更容易收缩和放松。心脏病发作后,相比携带MARK4的小鼠心肌细胞而言,在缺失MARK4的小鼠的心肌细胞中,其收缩的速度会增加42%,释放的速度也会增加47%,同时其功能也接近于健康心肌细胞的水平,这或许就展示出了降低MARK4的水平所产生的强大潜力。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


