特应性皮炎(AD)新药!礼来IL-13抑制剂lebrikizumab联合治疗关键3期研究成功:清除皮损、改善瘙痒!
来源:本站原创 2021-12-22 22:09
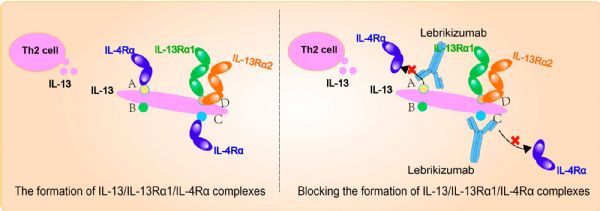
lebrikizumab是一种新型单抗,以高亲和力结合可溶性IL-13,阻断IL-13信号传导。
特应性皮炎(图片来源:icresearch.net)
2021年12月21日讯 /生物谷BIOON/ --礼来(Eli Lilly)近日公布了新型抗炎药——IL-13抑制剂lebrikizumab治疗中度至重度特应性皮炎(AD)第三项3期临床研究(ADvocate)的阳性顶线结果。该研究评估了lebrikizumab与皮质类固醇(TCS)联合用药方案的疗效和安全性。结果显示,在治疗第16周,该研究达到了主要终点和全部次要终点:lebrikizumab+TCS方案显著改善了疾病严重程度,并显著改善皮损清除、缓解瘙痒症状、改善生活质量。这些结果继续表明,IL-13细胞因子抑制在AD治疗中起着关键作用。
今年8月,礼来公布了2项关键3期临床研究(ADvocate 1,ADvocate 2)的阳性顶线结果。这2项研究评估了lebrikizumab作为单药疗法的疗效和安全性。结果显示,在治疗第16周,2项研究均达到了主要终点和全部次要终点,包括皮损清除和瘙痒改善及生活质量。数据显示:采用EASI评估,有一半以上的患者皮损清除改善≥75%。
lebrikizumab是一种新型单克隆抗体(mAb),能够以高亲和力结合可溶性IL-13,具有高生物利用度、长半衰期,可阻断IL-13信号转导。此前,美国FDA已授予lebrikizumab治疗中重度AD成人和青少年患者(12岁至18岁以下,体重≥40公斤)的快速通道资格(FTD)。礼来拥有lebrikizumab在美国、欧洲以外其他国家的独家开发和商业化权利。Almirall已授权在欧洲开发和商业化lebrikizumab,用于治疗包括AD在内的皮肤病适应症。
特应性皮炎(AD)也称为特应性湿疹,是一种由皮肤屏障功能障碍和免疫反应失调引起的慢性炎症性皮肤病。AD患者经常报告有强烈、持续的瘙痒症状,这种瘙痒非常令人不舒服,会影响睡眠、日常活动和社交关系。在AD患者中,IL-13蛋白(疾病的中心致病介质)过度表达,通过促进辅助性T细胞2(Th2)细胞炎症,从而驱动AD病理生理学的多个方面,导致皮肤屏障功能障碍、瘙痒、感染、皮肤区域变硬增厚。
ADhere研究的主要研究员、俄勒冈州健康与科学大学皮肤学教授Eric Simpson表示:“特应性皮炎的治疗往往很复杂,也很具挑战性,因为许多患者需要帮助控制其症状,而仅仅使用类固醇是不够的。总的疗效和安全性数据表明,lebrikizumab作为单一疗法和联合疗法的潜力,可以满足未满足的需求,并改善对AD引起的持续瘙痒和皮肤发炎患者的护理,这让我感到鼓舞。”
礼来免疫学开发副总裁Lotus Mallbris医学博士表示:“鉴于疾病的异质性以及患者体征和症状的不同结局,治疗特应性皮炎的医生继续需要为患者提供新的选择以及当前的护理标准。这些结果为lebrikizumab强大的3期临床试验项目提供了越来越多的证据,并支持了以下假设:即靶向IL-13通路对于治疗AD和帮助改善这些患者的预后至关重要。我们期待着在正在进行的研究中继续评估lebrikizumab的临床效用,并希望将这种药物提供给那些医疗需求仍然没有得到满足的人群。”
lebrikizumab作用机制(点击图片查看大图,来源:mosmedpreparaty.ru)
ADvocate是一项16周、随机、双盲、安慰剂对照、平行组3期研究,旨在评估lebrikizumab联合皮质类固醇(TCS)治疗中重度AD成人和青少年患者(12岁至18岁以下,体重至少40kg)。在该研究中,患者的AD症状采用TCS治疗无法充分控制,无论是否使用局部钙调神经磷酸酶抑制剂(TCI)。
主要疗效终点在第16周时进行评估:研究者总体评估(IGA)为皮损完全清除(IGA评分为0)或几乎完全清除(IGA评分为1)且相对基线改善≥2分、湿疹面积和严重程度指数(EASI)评分相对基线改善≥75%。
该研究中,与安慰剂+TCS相比,lebrikizumab+TCS达到了主要终点。此外,与安慰剂+TCS相比,lebrikizumab+TCS也达到了全部关键次要终点,包括:皮肤清除改善、瘙痒缓解、瘙痒对睡眠的干扰改善、生活质量改善。关键次要终点通过EASI、瘙痒数字评分量表(PNRS)、瘙痒引起的睡眠(Sleep-Loss due to Pruritus)、皮肤病生活质量指数(DLQI)进行测量。
在16周安慰剂对照ADhere研究中,安全性结果与lebrikizumab治疗AD 3期项目中的2项单药治疗研究(ADvocate 1,ADvocate 2)的16周结果一致。lebrikizumab治疗的患者中,最常见的不良事件为结膜炎、头痛。
ADhere研究的额外数据分析,以及ADvocate 1研究和ADvocate 2研究的结果,将在2022年的医学会议上公布。这些研究是lebrikizumab 3期项目的一部分,该项目包括5项关键的、正在进行的全球研究,包括2项单药治疗研究(ADvocate 1,ADvocate 2)和一项联合研究(ADhere)以及长期扩展(ADjoin)和青少年开放标签(ADore)试验。在成功完成正在进行的ADvocate 1和ADvocate 2研究后,礼来和Almirall打算2022年开始向美国、欧盟和其他监管机构提交lebrikizumab治疗中重度AD的上市申请。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->