全球第三款RNAi疗法!lumasiran治疗原发性高草尿酸症1型(PH1)儿科3期临床研究获得成功!
来源:本站原创 2020-10-10 22:18
lumasiran正在接受美欧审查,可解决原发性高草尿酸症1型(PH1)根本病因!

2020年10月10日讯 /生物谷BIOON/ --Alnylam制药公司是RNAi疗法开发领域的全球领导者,其药物Onpattro(patisiran,静脉制剂)于2018年8月获批,成为RNAi现象被发现整整20年以来获准上市的首款RNAi药物。2019年11月,Givlaari(givosiran,皮下制剂)获批,成为全球获批的第二款RNAi药物。目前,该公司另一款RNAi药物lumasiran正在接受美国FDA的优先审查、欧盟EMA的加速批准,该药用于治疗原发性高草酸尿症1型(PH1)。FDA已指定目标行动日期为2020年12月3日。
近日,Alnylam公司公布了评估lumasiran治疗PH1患者的ILLUMINATE-B儿科3期研究的阳性结果。这是一种RNAi药物在临床试验中获得阳性结果的第7项3期研究,也是评估RNAi药物治疗6岁以下儿童(包括婴儿)疗效和安全性的第一个研究。
ILLUMINATE-B(NCT03905694)是一项单臂、开放标签、多中心3期试验,在全球5个国家9个研究中心招募了18例年龄在6岁以下(范围:3-72个月)的PH1儿科患者。研究中,lumasiran按照基于体重的给药方案进行给药。
结果显示,在第6个月时,与基线相比,lumasiran治疗使尿液中草酸:肌酐比值显示出临床意义的降低。尿草酸相对于基线的减少,在所有3种体重类别(小于10公斤;10公斤到20公斤,以及20公斤或更高)中是一致的。lumasiran在次要终点也显示出阳性结果,包括尿和血浆草酸的额外测量指标。研究中,没有出现与研究药物相关的严重不良事件,并且lumasiran的总体安全性和耐受性与LIMITENT-A研究中观察到的一致。完整的ILLUMINATE-B研究结果将于2020年10月22日在ASN虚拟大会上公布。
PH1(图片来源:era-edta.org)
Alnylam公司lumasiran项目副总裁兼总经理Pritesh J. Gandhi博士表示:“我们很高兴地报告这些阳性结果,我们相信这些结果将会给许多受PH1影响的家庭带来希望。lumasiran的安全性和有效性与在6岁及以上患者中的研究报告一致,证明了lumasiran可以显著减少各年龄段肝脏草酸的生成,我们相信这可以解决PH1的内在病理生理学问题。目前,诊断为PH1的儿童和婴儿的护理标准很繁重,包括经常需要放置胃造瘘管以使水化过度,以及对于那些已发展为晚期疾病的患者,存在着进行透析和最终进行器官移植的风险。因此,我们相信,尿草酸水平的显著降低有潜力对非常年幼的患者的疾病进展和治疗产生积极影响。”
草酸症和高草酸尿基金会(Oxalosis and Hyperoxaluria Foundation)执行董事Kim Hollander表示:“ILLUMINATE-B的结果表明,为许多受PH1影响的儿童的家庭带来了希望。这一点尤其令人鼓舞,因为只有几个月大的儿童可以从lumasiran提供的治疗方法中获益,从源头上控制草酸的产生。我们感谢Alnylam对PH1社区的持续承诺,感谢他们设计并成功开展了一项针对特别脆弱的患者群体——幼儿和婴儿的研究。”
PH1是一种超级罕见、进行性、毁灭性疾病,影响肾脏和其他重要器官,该病由过量的草酸生成引起,尿草酸水平升高与进展到终末期肾病和其他全身并发症相关。PH1可导致肾衰竭,具有显著的发病率和死亡率,尚无批准的药物。目前的治疗方法,并不能防止草酸盐过量产生,只是减轻对肾脏的损害,延缓ESKD的进展。PH1该病影响婴儿、儿童和成人,患者面临着反复和痛苦的结石事件,以及肾功能进行性和不可预测的下降,最终导致终末期肾病,需要进行强化透析,作为肝/肾双重移植的桥梁。PH1通常在儿童期发病,需要立即进行有效的干预,晚期患者除了透析之外别无选择,而肝移植是目前唯一解决疾病根源的治疗方法。
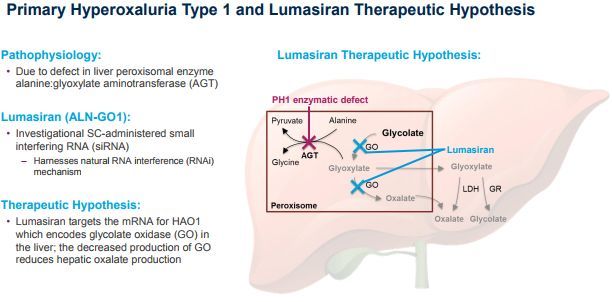
lumasiran是一种靶向羟基酸氧化酶1(HAO1)的皮下注射RNAi药物,开发用于原发性高草酸尿症1型(PH1)的治疗。HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1和消耗GO酶,lumasiran可抑制肝脏中草酸(直接参与PH1病理生理学的代谢物)的产生并使其正常化,从而潜在地阻止PH1疾病的进展。
lumasiran是第一种显示出显著减少尿草酸排泄量的疗法。来自III期ILLUMINATE-A研究(NCT03681184)的结果证实,lumasiran显著减少了肝脏中草酸的生成,有潜力解决PH1的内在病理生理学问题,并有潜力对PH1患者产生有意义的临床影响。在美国,lumasiran已被FDA授予治疗PH1的儿科罕见病资格、孤儿药资格(ODD)、突破性药物资格(BTD)。在欧盟,lumasiran已被授予孤儿药资格(ODD)、优先药物资格(PRIME)。这些资格认定,共同强调了lumasiran解决PH1潜在病理生理学问题的潜力。
lumasiran采用了Alnylam公司最新的增强稳定化学ESC-GalNAc共轭技术开发,该技术可使皮下给药具有更强的效力和持久性,并具有一个宽泛的治疗指数。目前,Alnylam公司正在开展另外一项全球性III期研究ILLUMINATE-C,评估lumasiran治疗伴有晚期肾脏病的所有年龄段PH1患者,预计2021年获得结果。(生物谷Bioon.com)
原文出处:Alnylam Reports Positive Topline Results from ILLUMINATE-B Phase 3 Study of Lumasiran for the Treatment of Primary Hyperoxaluria Type 1 in Children Under the Age of Six
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


