呵护女性私处健康!口服非唑类抗真菌药ibrexafungerp治疗外阴阴道念珠菌病III期项目成功!
来源:本站原创 2020-04-22 14:15
2020年04月22日讯 /生物谷BIOON/ --Scynexis是一家总部位于美国新泽西州的生物技术公司,专注于开发创新疗法,用于克服和预防难以治疗和耐药的感染。近日,该公司公布了新型广谱抗真菌药物ibrexafungerp III期VANISH-306研究的阳性顶线结果。该研究调查了口服ibrexafungerp治疗外阴阴道念珠菌病(VVC)的疗效和安

2020年04月22日讯 /生物谷BIOON/ --Scynexis是一家总部位于美国新泽西州的生物技术公司,专注于开发创新疗法,用于克服和预防难以治疗和耐药的感染。近日,该公司公布了新型广谱抗真菌药物ibrexafungerp III期VANISH-306研究的阳性顶线结果。
该研究调查了口服ibrexafungerp治疗外阴阴道念珠菌病(VVC)的疗效和安全性。结果显示,与安慰剂相比,ibrexafungerp在主要终点和关键次要终点方面具有高度统计学优势、安全性和耐受性良好。该研究的阳性结果与之前报道的III期VANISH-303研究一致。在这2项VANISH关键试验中的主要终点和关键次要终点是监管批准VVC适应症所要求的,研究数据为2020年下半年提交ibrexafungerp治疗VVC的监管申请文件铺平了道路。
ibrexafungerp是一种新型、广谱抗真菌药,也是结构独特的葡聚糖合成酶抑制剂类抗菌药三萜(triterpenoids)中的首个代表。ibrexafungerp结合了葡聚糖合成酶抑制剂的良好活性以及口服和静脉注射给药的潜在灵活性。目前,该药正开发用于治疗念珠菌(包括耳念珠菌,C.auris)和曲霉菌引起的真菌感染。在体外和体内研究中,该药针对多种耐药病原体(包括对唑和棘白菌素耐药菌株)表现出了广谱抗真菌活性。
此次公布VANISH-306研究顶线结果,标志着VANISH III期项目的成功完成。Scynexis公司计划于今年晚些时候向美国食品和药物管理局(FDA)提交新药申请(NDA)。如果获得批准,ibrexafungerp将成为用于治疗阴道酵母菌感染的第一个也是唯一一个口服非唑类药物。阴道酵母菌感染是一种在一生中可影响多达四分之三女性的疾病,但治疗方案有限,20多年来没有批准新的疗法。VANISH项目的积极结果表明,ibrexafungerp有潜力解决广泛疾病严重程度的阴道酵母菌感染,该药将是一个理想的治疗选择,特别是对于目前不满意现有疗法的患者。
Scynexis首席医疗官David Angulo医学博士表示:“我们对来自VANISH-306的结果感到兴奋,这与之前报道的VANISH-303研究结果一致,支持口服ibrexafungerp作为治疗阴道酵母菌感染的一种新疗法的疗效和安全性。两项VANISH III期研究也证实了在25天的随访中ibrexafungerp的持续临床效果,这与IIb期DOVE研究的结果一致。同时,我们正在继续推进CANDLE III期研究,测试口服ibrexafungerp预防复发性阴道酵母菌感染(目前还没有批准的治疗方法),并预计2021年下半年报告针对该适应症的最新数据。”
外阴阴道念珠菌病(VVC)俗称念珠菌引起的阴道酵母菌感染,是第二常见的阴道炎病因。虽然这些感染通常是由白色念珠菌(Candida albicans)引起的,但氟康唑(fluconazole)耐药的念珠菌菌株,如光滑念珠菌(Candida glabrata),已经被报道越来越普遍。VVC可导致严重的发病率,包括严重的生殖器不适、性快感降低、心理痛苦和生产力丧失。典型的VVC症状包括瘙痒、阴道酸痛、刺激、阴道粘膜脱落和阴道分泌物异常。
据估计,全世界70-75%的女性一生中至少会有一次VVC发作,40-50%的女性会经历两次或两次以上VVC发作。大约6-8%的VVC患者患有复发性疾病,定义为在12个月内至少经历三次发作。
目前,对VVC的治疗包括几种外用唑类抗真菌药物(克霉唑、咪康唑等)和氟康唑,后者是目前美国唯一批准用于治疗VVC的口服抗真菌药物。氟康唑在其标签中报告了55%的治疗治愈率,现在还包括对胎儿潜在伤害的警告,表明需要新的口服替代品。口服氟康唑或外用药物不能完全满足中重度VVC、反复VVC、抗氟康唑念珠菌引起的VVC、育龄期VVC的女性患者需求。此外,对于氟康唑治疗无反应或不耐受的VVC患者,没有口服替代品,也没有FDA批准的预防复发性VVC的产品。
ibrexafungerp是一种新型、广谱抗真菌药,也是结构独特的葡聚糖合成酶抑制剂类抗菌药三萜(triterpenoids)中的首个代表。ibrexafungerp结合了葡聚糖合成酶抑制剂的良好活性以及口服和静脉注射给药的潜在灵活性。目前,该药正开发用于治疗念珠菌(包括耳念珠菌,C.auris)和曲霉菌引起的真菌感染。在体外和体内研究中,该药针对多种耐药病原体(包括对唑和棘白菌素耐药菌株)表现出了广谱抗真菌活性。之前,美国FDA已授予ibrexafungerp口服和静脉制剂治疗侵袭性念珠菌病(IC,包括念珠菌血症)、侵袭性曲霉菌病(IA)、外阴阴道念珠菌病(VVC)的合格传染病产品(QIDP)和快速通道资格(FTD),并授予了治疗IC、IA适应症的孤儿药资格(ODD)。ibrexafungerp以前被称为SCY-078。
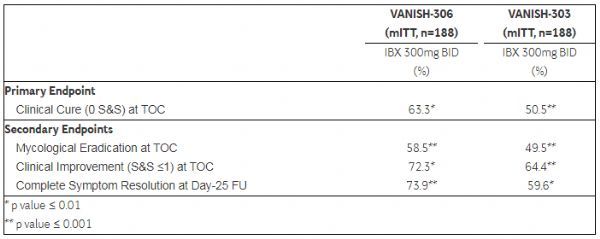
VANISH-306研究的疗效结果:(1)63.3%的ibrexafungerp治疗患者在第10天治愈检验(test-of-cure,TOC)访视时达到了临床治愈的主要终点,临床治愈定义为在单日600mg剂量方案(两剂300mg,间隔12小时服用)后所有阴道体征和症状(S&S)完全消失。(2)58.5%的ibrexafungerp治疗患者在TOC访视时达到了真菌根除的次要终点,即阴性培养。(3)72.3%的ibrexafungerp治疗患者在TOC访视时被归类为临床改善,定义为总的体征和症状评分为0或1。(4)73.9%的患者在第25天访视时症状完全消失。
安全结果:在VANISH-306研究中,口服ibrexafungerp通常是安全和耐受性良好的。严重不良事件(SAE)是罕见的,没有药物相关的SAE。与以往的研究相似,在VANISH-306研究中观察到的ibrexafungerp治疗组,以较高频率出现的大多数因治疗引起的不良事件(TEAE)本质上是胃肠道(GI)事件,其中三种最常见的胃肠道事件(腹泻/稀粪、恶心、腹痛)发生率分别为9.4%、8.4%、2.7%。这些事件多数是轻微的、持续时间短、没有导致停药,这证实了先前观察到的单日600mg口服ibrexafungerp方案的良好耐受性。
VANISH和DOVE项目中VVC患者的联合安全性数据库目前包括超过850例入组患者,其中575例患者接受了单日600mg剂量ibrexafungerp治疗方案。在总数据库中,ibrexafungerp治疗患者最常见的胃肠道事件的总发生率为腹泻/稀粪16.7%、恶心11.8%、腹痛4.5%,数据支持ibrexafungerp良好的安全性和耐受性。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->