CAR-T细胞疗法研究进展(第17期)
来源:本站原创 2020-09-27 22:39
2020年9月27日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一
2020年9月27日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.JCI:重大进展!开发出CAART细胞疗法,有望治疗粘膜寻常型天疱疮等自身免疫性疾病
doi:10.1172/JCI138416
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现,在动物模型中,一种强大的潜在治疗自身免疫性疾病粘膜寻常型天疱疮(pemphigus vulgaris, PV)的新方法是安全而有效的。他们根据从一种名为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的前沿抗癌策略中获得的经验,设计和开发了这种新的细胞靶向疗法,其中,CAR-T细胞疗法是对患者自身的T细胞进行基因改造,然后将这些经过基因改造的T细胞灌注回患者体内来攻击癌细胞。类似的基因修饰可引导T细胞选择性地破坏导致粘膜PV的自身反应性B细胞。这些发现为启动临床研究铺平了道路,并为可能开发基于细胞的自身免疫性疾病新疗法建立了临床前测试模式。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“Antigen-specific B-cell depletion for precision therapy of mucosal pemphigus vulgaris”。

在标准的CAR-T细胞方法中,医生从患者血液中采集T细胞,对这些T细胞进行基因改造使之攻击B细胞,在实验室中培养并扩增这些经过基因改造的T细胞,然后将这些CAR-T细胞重新注入患者体内,以寻找并消灭体内所有的B细胞,包括导致淋巴瘤的B细胞和正常的B细胞。 不过,这些研究人员并没有采用CAR-T细胞策略来消灭PV患者体内的所有B细胞,而是对这种策略进行了调整,使得它变得更加精准;具体的想法就是对PV患者的T细胞进行基因改造,使得DSG3成为经过基因改造后的T细胞表面上的诱饵受体的一部分,并对这些T细胞进行编程,使之仅攻击和杀死产生抗DSG3抗体的B细胞。这种“外科手术式打击”的方法原则上只破坏产生抗DSG3抗体的特定B细胞,而使得免疫系统的其他部分保持完整,因而避免了广泛的免疫抑制给患者带来的感染风险的增加。
2.Cell:研究揭示免疫疗法引发神经毒性的原因
doi:10.1016/j.cell.2020.08.022
最近一项新研究发现,在保护血脑屏障(BBB)的脑细胞中发现了CD19分子。众所周知,CD19是CAR-T细胞免疫疗法中的明星靶点,广泛表达于白血病,淋巴瘤和多发性骨髓瘤细胞表面。
Perelman医学院系统药理学和转化治疗学助理教授Avery Posey博士领导的研究小组发现表明,这可能是接受CD19 CAR T细胞免疫疗法的患者出现神经毒性的原因。相关结果发表在《Cell》杂志上。Posey说:“我们的研究表明,部分非B细胞中存在CD19表达,这可能与我们在以CD19为靶点的CAR T细胞疗法治疗的患者中观察到的神经毒性有关。因此,我们是否可以确定一个更好的靶标来消除CD19以外的与B细胞相关的恶性肿瘤,或者我们可以围绕CD19的这种脑细胞表达进行工程改造,并对CAR T细胞进行优化。”
该小组观察到,将CAR T细胞靶向导入小鼠中时,即使小鼠缺乏B细胞,其大脑血脑屏障通透性也会提高,但是当以人CD19作为对照治疗时(小鼠不表达人CD19),血脑屏障通透性则没有明显变化。与针对其他B细胞蛋白(例如CD20)的治疗相比, CD19免疫治疗中神经毒性的发生率更高,该研究强调了寻找除B细胞之外的任何潜在表达CD19分子的细胞亚群的重要性。
3.Science子刊:溶瘤病毒和CAR-T细胞疗法联手可有效根除实体瘤
doi:10.1126/scitranslmed.aaz1863
在一项新的研究中,来自美国希望之城的研究人员将两种强效的免疫疗法---溶瘤病毒(oncolytic virus)和嵌合抗原受体(CAR)T细胞(CAR-T)疗法---结合起来,成功地靶向和根除单独用CAR-T细胞疗法很难治疗的实体瘤。相关研究结果发表在2020年9月2日的Science Translational Medicine期刊上,论文标题为“Effective combination immunotherapy using oncolytic viruses to deliver CAR targets to solid tumors”。
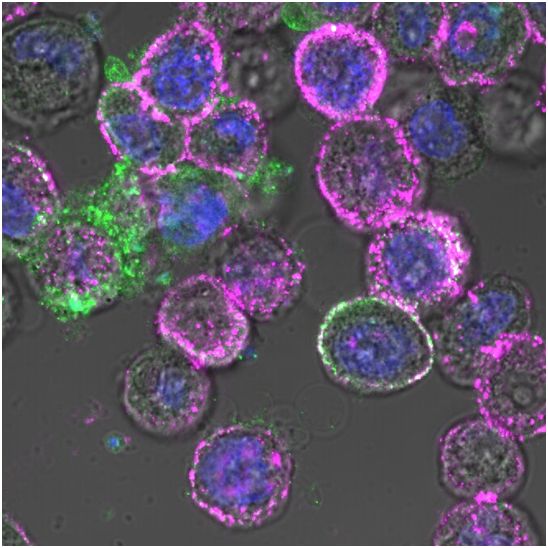
在这项可能导致对难治性实体瘤患者进行临床试验的临床前研究中,这些研究人员通过对溶瘤病毒进行基因改造,使之进入肿瘤细胞,并诱导它们在肿瘤细胞表面上表达CD19蛋白。然后,他们能够使用靶向CD19的CAR-T细胞来识别和攻击这些实体瘤。
CD19 CAR-T细胞疗法已被美国食品药品管理局(FDA)批准用于治疗某些类型的血液癌症,即B细胞淋巴瘤和急性淋巴细胞白血病。这项新的研究可能会扩大CD19 CAR-T细胞的使用范围,用于治疗可能患有任何实体瘤的患者。
论文共同通讯作者、希望之城血液学与造血细胞移植系助理教授Saul Priceman博士说,“我们的研究表明溶瘤病毒是一种强大而有前途的方法,可以与CAR-T细胞疗法战略性地结合起来,以便更有效地靶向实体瘤。”
4.Nat Med:开发出靶向HIV病毒库的Dual-CAR-T细胞,为治愈HIV感染奠定基础
doi:10.1038/s41591-020-1039-5
在一项新的研究中,来自美国拉根研究所、宾夕法尼亚大学和麻省总医院的研究人员描述了一种新型双CAR-T(Dual CAR T cell, Dual-CAR-T)细胞免疫疗法可以帮助对抗HIV感染。相关研究结果于2020年8月31日在线发表在Nature Medicine期刊上,论文标题为“Dual CD4-based CAR T cells with distinct costimulatory domains mitigate HIV pathogenesis in vivo”。论文通讯作者为拉根研究所的Todd Allen博士和宾夕法尼亚大学佩雷尔曼医学院微生物学教授Jim Riley博士。论文第一作者为宾夕法尼亚大学佩雷尔曼医学院研究生Colby Maldini和拉根研究所研究员Daniel Claiborne博士。
作为一种新型的CAR-T细胞,这种Dual-CAR-T细胞是通过对T细胞进行基因改造使得同一个T细胞表达两种CAR。每种CAR都携带一个CD4蛋白,使得它能够靶向HIV感染细胞,而且每种CAR还有一个共刺激结构域,用于向CAR-T细胞发出信号,增加这些T细胞的免疫功能。第一种CAR含有4-1BB共刺激结构域,可刺激细胞增殖和持久性,而第二种CAR具有CD28共刺激结构域,可增加这些T细胞杀伤HIV感染细胞的能力。
由于HIV经常感染T细胞,他们还添加了一种叫做C34-CXCR4的蛋白,这种蛋白是在宾夕法尼亚大学佩雷尔曼医学院血液肿瘤科教授James Hoxie博士的实验室中开发出的。C34-CXCR4可以防止HIV附着在T细胞上,因而也就阻止这种病毒感染它们。最终产生的Dual-CAR-T细胞寿命长,在应对HIV感染时进行复制,有效杀灭被感染的细胞,并对HIV感染形成部分抵抗力。
当将受保护的Dual-CAR-T细胞给送到HIV感染的小鼠体内时,这些研究人员观察到HIV复制速度变得较慢,而且相比于未给送Dual-CAR-T细胞的小鼠,它们具有更少的HIV感染细胞。他们还观察到这些小鼠血液中的HIV病毒数量减少,CD4+T细胞得以保存下来。此外,当他们在HIV感染的小鼠中组合使用Dual-CAR-细胞细胞和ART时,这种病毒被更快地抑制,这就导致HIV病毒库比仅接受ART治疗的小鼠更小。
5.bioRxiv:详解我国科学家开发出针对SARS-CoV-2的CAR-M细胞免疫疗法
doi:10.1101/2020.07.26.222208
在一项新的研究中,来自中国第二军医大学和上海交通大学医学院的研究人员开发出一系列基于识别SARS-CoV-2刺突蛋白(S蛋白)的CAR受体,并测试了它们诱导对SARS-CoV-2病毒颗粒的吞噬能力。有趣的是,这些作者报道了一种具有MER酪氨酸激酶(MERTK)胞内结构域的CAR,即CARMERTK,而且与其他CAR相比,它在基于表达抗原的细胞模型中并没有表现出明显的杀伤作用,但在体外在没有促炎细胞因子(proinflammatory cytokine)分泌的情形下却表现出对SARS-CoV-2病毒颗粒的抗原特异性清除。相关研究结果于2020年7月27日在线发表在预印本服务器bioRxiv上,论文标题为“CAR Macrophages for SARS-CoV-2 Immunotherapy”。

巨噬细胞能抵御感染、清除体内破损或异常的细胞,以其吞噬活性、抗原呈递能力和灵活的表型著称。肺实质中的先天免疫反应以骨髓源性单核细胞分化为巨噬细胞为特征,是肺部对抗入侵病原体的一线防御。一般来说,单核细胞/巨噬细胞能够显著地限制病毒的复制。在病毒感染过程中,单核细胞增强的促炎症信号分子水平和引发的抗病毒反应已被证实适用于流感病毒、疱疹病毒和寨卡病毒。此外,最近有研究表明,一些COVID-19患者具有增强的促炎巨噬细胞活性,从而导致炎症细胞因子和趋化因子的加速产生,并且多在预后不良的受试者中观察到。
据这些作者所知,目前还没有研究出基于合成细胞的COVID-19免疫疗法。表达CAR的T细胞(CAR-T)已经被证明是治疗B细胞癌症患者的一种非常有效的方法。利用经过基因改造的巨噬细胞的力量开发针对实体瘤的新型治疗方法是非常有意义的,这是因为CAR-T细胞疗法常常受到T细胞无法穿透实体瘤和抑制性肿瘤微环境的阻碍。与之前的报告相一致的是,具有胞质免疫受体酪氨酸基激活基团(immunoreceptor tyrosine-based activation motif, ITAM)的CAR受体能够触发巨噬细胞特异性吞噬和杀死抗原表达细胞。在这些作者的数据中,这些表达CAR的巨噬细胞(CAR-M)也表现出对SARS-COV-2病毒颗粒的强大吞噬能力;然而,这种效果伴随着促炎细胞因子IFN-γ、IL-6和IL-8的分泌增加。在CAR-T细胞治疗中,经过基因改造的T细胞增殖通常伴随着高水平的细胞因子释放综合征,干扰素-γ(IFN-γ)、粒细胞集落刺激因子(G-CSF)、IL-6、IL-8和IL-10的循环水平升高。最近的报道已表明,宿主来源的单核细胞/巨噬细胞和CAR-T细胞之间的相互作用在细胞因子释放综合征的病理生理学中起着重要作用。这是有意义的,这是因为类似的炎症细胞因子的血清水平增加与COVID-19的严重性和死亡有关。有趣的是,在经SARS-CoV-2病毒颗粒处理的CARγ和CARζ细胞中,IL-6、IL-8、TNF-α、IFN-γ和IL-10的分泌明显升高,这提示这些CAR-M细胞可能不适合应用于重症或晚期COVID-19患者中。 (生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.JCI:重大进展!开发出CAART细胞疗法,有望治疗粘膜寻常型天疱疮等自身免疫性疾病
doi:10.1172/JCI138416
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现,在动物模型中,一种强大的潜在治疗自身免疫性疾病粘膜寻常型天疱疮(pemphigus vulgaris, PV)的新方法是安全而有效的。他们根据从一种名为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的前沿抗癌策略中获得的经验,设计和开发了这种新的细胞靶向疗法,其中,CAR-T细胞疗法是对患者自身的T细胞进行基因改造,然后将这些经过基因改造的T细胞灌注回患者体内来攻击癌细胞。类似的基因修饰可引导T细胞选择性地破坏导致粘膜PV的自身反应性B细胞。这些发现为启动临床研究铺平了道路,并为可能开发基于细胞的自身免疫性疾病新疗法建立了临床前测试模式。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“Antigen-specific B-cell depletion for precision therapy of mucosal pemphigus vulgaris”。

图片来自Journal of Clinical Investigation, 2020, doi:10.1172/JCI138416。
在标准的CAR-T细胞方法中,医生从患者血液中采集T细胞,对这些T细胞进行基因改造使之攻击B细胞,在实验室中培养并扩增这些经过基因改造的T细胞,然后将这些CAR-T细胞重新注入患者体内,以寻找并消灭体内所有的B细胞,包括导致淋巴瘤的B细胞和正常的B细胞。 不过,这些研究人员并没有采用CAR-T细胞策略来消灭PV患者体内的所有B细胞,而是对这种策略进行了调整,使得它变得更加精准;具体的想法就是对PV患者的T细胞进行基因改造,使得DSG3成为经过基因改造后的T细胞表面上的诱饵受体的一部分,并对这些T细胞进行编程,使之仅攻击和杀死产生抗DSG3抗体的B细胞。这种“外科手术式打击”的方法原则上只破坏产生抗DSG3抗体的特定B细胞,而使得免疫系统的其他部分保持完整,因而避免了广泛的免疫抑制给患者带来的感染风险的增加。
2.Cell:研究揭示免疫疗法引发神经毒性的原因
doi:10.1016/j.cell.2020.08.022
最近一项新研究发现,在保护血脑屏障(BBB)的脑细胞中发现了CD19分子。众所周知,CD19是CAR-T细胞免疫疗法中的明星靶点,广泛表达于白血病,淋巴瘤和多发性骨髓瘤细胞表面。
Perelman医学院系统药理学和转化治疗学助理教授Avery Posey博士领导的研究小组发现表明,这可能是接受CD19 CAR T细胞免疫疗法的患者出现神经毒性的原因。相关结果发表在《Cell》杂志上。Posey说:“我们的研究表明,部分非B细胞中存在CD19表达,这可能与我们在以CD19为靶点的CAR T细胞疗法治疗的患者中观察到的神经毒性有关。因此,我们是否可以确定一个更好的靶标来消除CD19以外的与B细胞相关的恶性肿瘤,或者我们可以围绕CD19的这种脑细胞表达进行工程改造,并对CAR T细胞进行优化。”
该小组观察到,将CAR T细胞靶向导入小鼠中时,即使小鼠缺乏B细胞,其大脑血脑屏障通透性也会提高,但是当以人CD19作为对照治疗时(小鼠不表达人CD19),血脑屏障通透性则没有明显变化。与针对其他B细胞蛋白(例如CD20)的治疗相比, CD19免疫治疗中神经毒性的发生率更高,该研究强调了寻找除B细胞之外的任何潜在表达CD19分子的细胞亚群的重要性。
3.Science子刊:溶瘤病毒和CAR-T细胞疗法联手可有效根除实体瘤
doi:10.1126/scitranslmed.aaz1863
在一项新的研究中,来自美国希望之城的研究人员将两种强效的免疫疗法---溶瘤病毒(oncolytic virus)和嵌合抗原受体(CAR)T细胞(CAR-T)疗法---结合起来,成功地靶向和根除单独用CAR-T细胞疗法很难治疗的实体瘤。相关研究结果发表在2020年9月2日的Science Translational Medicine期刊上,论文标题为“Effective combination immunotherapy using oncolytic viruses to deliver CAR targets to solid tumors”。

当溶瘤病毒被添加到癌细胞中后,它迫使大量的CD19在癌细胞表面上表达(紫色)。图片来自 City of Hope。
在这项可能导致对难治性实体瘤患者进行临床试验的临床前研究中,这些研究人员通过对溶瘤病毒进行基因改造,使之进入肿瘤细胞,并诱导它们在肿瘤细胞表面上表达CD19蛋白。然后,他们能够使用靶向CD19的CAR-T细胞来识别和攻击这些实体瘤。
CD19 CAR-T细胞疗法已被美国食品药品管理局(FDA)批准用于治疗某些类型的血液癌症,即B细胞淋巴瘤和急性淋巴细胞白血病。这项新的研究可能会扩大CD19 CAR-T细胞的使用范围,用于治疗可能患有任何实体瘤的患者。
论文共同通讯作者、希望之城血液学与造血细胞移植系助理教授Saul Priceman博士说,“我们的研究表明溶瘤病毒是一种强大而有前途的方法,可以与CAR-T细胞疗法战略性地结合起来,以便更有效地靶向实体瘤。”
4.Nat Med:开发出靶向HIV病毒库的Dual-CAR-T细胞,为治愈HIV感染奠定基础
doi:10.1038/s41591-020-1039-5
在一项新的研究中,来自美国拉根研究所、宾夕法尼亚大学和麻省总医院的研究人员描述了一种新型双CAR-T(Dual CAR T cell, Dual-CAR-T)细胞免疫疗法可以帮助对抗HIV感染。相关研究结果于2020年8月31日在线发表在Nature Medicine期刊上,论文标题为“Dual CD4-based CAR T cells with distinct costimulatory domains mitigate HIV pathogenesis in vivo”。论文通讯作者为拉根研究所的Todd Allen博士和宾夕法尼亚大学佩雷尔曼医学院微生物学教授Jim Riley博士。论文第一作者为宾夕法尼亚大学佩雷尔曼医学院研究生Colby Maldini和拉根研究所研究员Daniel Claiborne博士。
作为一种新型的CAR-T细胞,这种Dual-CAR-T细胞是通过对T细胞进行基因改造使得同一个T细胞表达两种CAR。每种CAR都携带一个CD4蛋白,使得它能够靶向HIV感染细胞,而且每种CAR还有一个共刺激结构域,用于向CAR-T细胞发出信号,增加这些T细胞的免疫功能。第一种CAR含有4-1BB共刺激结构域,可刺激细胞增殖和持久性,而第二种CAR具有CD28共刺激结构域,可增加这些T细胞杀伤HIV感染细胞的能力。
由于HIV经常感染T细胞,他们还添加了一种叫做C34-CXCR4的蛋白,这种蛋白是在宾夕法尼亚大学佩雷尔曼医学院血液肿瘤科教授James Hoxie博士的实验室中开发出的。C34-CXCR4可以防止HIV附着在T细胞上,因而也就阻止这种病毒感染它们。最终产生的Dual-CAR-T细胞寿命长,在应对HIV感染时进行复制,有效杀灭被感染的细胞,并对HIV感染形成部分抵抗力。
当将受保护的Dual-CAR-T细胞给送到HIV感染的小鼠体内时,这些研究人员观察到HIV复制速度变得较慢,而且相比于未给送Dual-CAR-T细胞的小鼠,它们具有更少的HIV感染细胞。他们还观察到这些小鼠血液中的HIV病毒数量减少,CD4+T细胞得以保存下来。此外,当他们在HIV感染的小鼠中组合使用Dual-CAR-细胞细胞和ART时,这种病毒被更快地抑制,这就导致HIV病毒库比仅接受ART治疗的小鼠更小。
5.bioRxiv:详解我国科学家开发出针对SARS-CoV-2的CAR-M细胞免疫疗法
doi:10.1101/2020.07.26.222208
在一项新的研究中,来自中国第二军医大学和上海交通大学医学院的研究人员开发出一系列基于识别SARS-CoV-2刺突蛋白(S蛋白)的CAR受体,并测试了它们诱导对SARS-CoV-2病毒颗粒的吞噬能力。有趣的是,这些作者报道了一种具有MER酪氨酸激酶(MERTK)胞内结构域的CAR,即CARMERTK,而且与其他CAR相比,它在基于表达抗原的细胞模型中并没有表现出明显的杀伤作用,但在体外在没有促炎细胞因子(proinflammatory cytokine)分泌的情形下却表现出对SARS-CoV-2病毒颗粒的抗原特异性清除。相关研究结果于2020年7月27日在线发表在预印本服务器bioRxiv上,论文标题为“CAR Macrophages for SARS-CoV-2 Immunotherapy”。

CAR-巨噬细胞(CAR-M细胞)的生成和表征,图片来自bioRxiv, 2020, doi:10.1101/2020.07.26.222208。
巨噬细胞能抵御感染、清除体内破损或异常的细胞,以其吞噬活性、抗原呈递能力和灵活的表型著称。肺实质中的先天免疫反应以骨髓源性单核细胞分化为巨噬细胞为特征,是肺部对抗入侵病原体的一线防御。一般来说,单核细胞/巨噬细胞能够显著地限制病毒的复制。在病毒感染过程中,单核细胞增强的促炎症信号分子水平和引发的抗病毒反应已被证实适用于流感病毒、疱疹病毒和寨卡病毒。此外,最近有研究表明,一些COVID-19患者具有增强的促炎巨噬细胞活性,从而导致炎症细胞因子和趋化因子的加速产生,并且多在预后不良的受试者中观察到。
据这些作者所知,目前还没有研究出基于合成细胞的COVID-19免疫疗法。表达CAR的T细胞(CAR-T)已经被证明是治疗B细胞癌症患者的一种非常有效的方法。利用经过基因改造的巨噬细胞的力量开发针对实体瘤的新型治疗方法是非常有意义的,这是因为CAR-T细胞疗法常常受到T细胞无法穿透实体瘤和抑制性肿瘤微环境的阻碍。与之前的报告相一致的是,具有胞质免疫受体酪氨酸基激活基团(immunoreceptor tyrosine-based activation motif, ITAM)的CAR受体能够触发巨噬细胞特异性吞噬和杀死抗原表达细胞。在这些作者的数据中,这些表达CAR的巨噬细胞(CAR-M)也表现出对SARS-COV-2病毒颗粒的强大吞噬能力;然而,这种效果伴随着促炎细胞因子IFN-γ、IL-6和IL-8的分泌增加。在CAR-T细胞治疗中,经过基因改造的T细胞增殖通常伴随着高水平的细胞因子释放综合征,干扰素-γ(IFN-γ)、粒细胞集落刺激因子(G-CSF)、IL-6、IL-8和IL-10的循环水平升高。最近的报道已表明,宿主来源的单核细胞/巨噬细胞和CAR-T细胞之间的相互作用在细胞因子释放综合征的病理生理学中起着重要作用。这是有意义的,这是因为类似的炎症细胞因子的血清水平增加与COVID-19的严重性和死亡有关。有趣的是,在经SARS-CoV-2病毒颗粒处理的CARγ和CARζ细胞中,IL-6、IL-8、TNF-α、IFN-γ和IL-10的分泌明显升高,这提示这些CAR-M细胞可能不适合应用于重症或晚期COVID-19患者中。 (生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


