慢性移植物抗宿主病(cGVHD)突破性药物!ROCK2抑制剂belumosudil美国进入审查:总缓解率>70%
来源:本站原创 2020-12-04 18:14
belumosudil有潜力成为cGVHD治疗模式的基石,为患者带来有意义和持续的益处。

2020年12月04日讯 /生物谷BIOON/ --Kadmon Holdings近日宣布,美国食品和药物管理局(FDA)已受理belumosudil(KD025)的新药申请(NDA),该药是一种口服选择性Rho关联卷曲螺旋蛋白激酶2(ROCK2)抑制剂,用于治疗慢性移植物抗宿主病(cGVHD)患者。FDA已授予NDA优先审查,并已指定《处方药用户收费法》(PDUFA)目标日期为2021年5月30日。该NDA将在FDA实时肿瘤学审查(RTOR)和Orbis试点项目下进行审查。
Kadmon根据FDA的实时肿瘤学审查(RTOR)试点项目提交了belumosudil的NDA。该试点项目旨在探索更有效的审查流程,以确保患者尽早获得安全有效的治疗,同时保持和提高审查质量。belumosudil NDA的审查也将在FDA的Orbis项目下进行,这是FDA肿瘤卓越中心的一项倡议。Oribs项目为国际合作伙伴间肿瘤产品的同时提交和审查提供了框架。
cGVHD是造血干细胞移植后常见的致命并发症。在cGVHD中,移植免疫细胞(移植物)攻击患者的细胞(宿主),导致皮肤、口腔、眼睛、关节、肝脏、肺、食道和胃肠道等多个组织的炎症和纤维化。在美国,目前约有14000例cGVHD患者,每年新增约5000例患者。
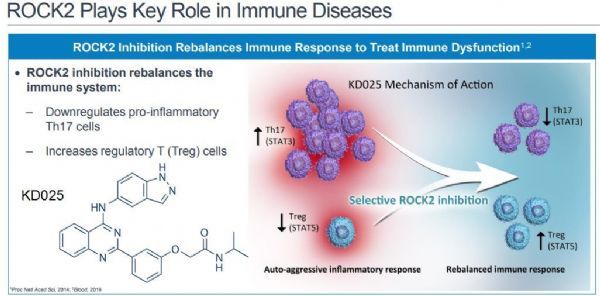
belumosudil是Rho关联卷曲螺旋蛋白激酶2(ROCK2)的选择性口服抑制剂,ROCK2是一种调节免疫应答和纤维化途径的信号通路。belumosudil抑制ROCK2信号通路,可下调促炎性Th17细胞、增加调节性T(Treg)细胞,重新平衡免疫应答,治疗免疫功能障碍。除了cGVHD之外,belumosudil正在进行一项成人弥漫性皮肤系统性硬化症的II期临床试验(KD025-209)。此前,belumosudil被美国食品和药物管理局(FDA)授予了突破性药物资格(BTD)和孤儿药物资格(ODD),用于治疗先前接受过至少两种系统治疗的cGVHD患者。
belumosudil(KD025)化学结构及作用机制
belumosudil NDA得到了来自关键临床试验ROCKstar(KD025-213,NCT03640481)阳性结果的支持。这是一项随机、多中心、开放标签II期研究,在先前接受过至少2种系统疗法的cGVHD成人和青少年患者中开展。研究中,患者随机分配进入2个组,分别接受belumosudil每日一次200mg(200mg QD)、每日2次200mg(200mg BID)治疗,每组66例患者。该研究中,如果总缓解率(ORR)的95%CI的下限值超过30%,则达到统计学显著性。
之前公布的结果显示,在完成患者入组后的2个月开展的一项中期分析(2019年10月)中,研究已经达到了ORR终点。数据显示,KD025 200mg QD组、200mg BID组的ORR分别为64%(95%CI:51%,75%,p<0.0001)、67%(95%CI:54%,78%,p<0.0001),数据具有统计学意义和临床意义。
今年5月公布的阳性顶线结果显示:在完成患者入组后的6个月开展的主要分析中,KD025 200mg QD组、200mg BID组的ORR分别为73%(95%CI:60%,83%,p<0.0001)、74%(95%CI:62%,84%,p<0.0001),数据具有临床意义和统计学意义。此外,在全部关键患者亚组均观察到了治疗缓解、在全部受影响的器官系统中均观察到了完全缓解,包括有纤维化疾病的器官中。研究中,belumosudil的耐受性良好,不良反应与在该患者群体中的预期一致。未发现巨细胞病毒(CMV)感染或重新激活,也未发现明显的药物相关性细胞减少。
该研究的12个月数据将在2020年12月6日举行的美国血液学会(ASH)第62届年会上以口头形式呈现。KD025-208和ROCKstar研究的调查员、ROCKstar指导委员会主席、范德比尔特-英格拉姆癌症中心(VICC)首席医学官、范德比尔特大学医学中心医学教授Madan Jagasia此前表示:“cGVHD是一个有着重大未满足医疗需求的领域,belumosudil在治疗晚期cGVHD方面已显示出了令人信服的结果。重要的是,belumosudil的耐受性非常好,这使得试验参与者能够坚持治疗并获得有意义的治疗缓解。这些结果表明,如果得到批准,belumosudil有潜力成为cGVHD治疗模式的基石,将为患有这种严重疾病的患者带来有意义和持续的益处。”(生物谷Bioon.com)
原文出处:Kadmon Announces FDA Acceptance of NDA for Belumosudil in Patients With Chronic Graft-Versus-Host Disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->