多篇文章解读肥胖所致多种人类疾病背后的分子机制!
来源:生物谷原创 2024-08-29 11:30
揭示肥胖导致非酒精性脂肪肝病进展的新机制、肥胖会因 RalA 激活而导致白色脂肪细胞线粒体破碎和功能障碍、中国科学家发现肥胖或会导致大脑缩小、白质病变增加
肥胖对机体健康会产生很大影响,本文中,小编整理了多篇研究报告共同揭示肥胖到底会给人类健康带来哪些危害,与大家一起学习!
【1】Cell Metabol:揭示肥胖导致非酒精性脂肪肝病进展的新机制
doi:10.1016/j.cmet.2024.04.014
肥胖会改变控制肝脏免疫代谢稳态的下丘脑激素水平,而下丘脑功能紊乱会导致非酒精性脂肪肝病(NAFLD)。但肥胖对下丘脑稳态的具体影响目前尚不清楚。近日,一篇发表在国际杂志Cell Metabolism上题为“Obesity disrupts the pituitary-hepatic UPR communication leading to NAFLD progression”的研究报告中,来自爱荷华大学等机构的科学家们通过研究发现,肥胖会破坏垂体-肝脏未折叠蛋白反应(UPR)通讯,导致非酒精性脂肪肝病(NAFLD)进展。

揭示肥胖导致非酒精性脂肪肝病进展的新机制
图片来源:Cell Metabolism(2024) doi:10.1016/j.cmet.2024.04.014
文章中,研究人员发现肥胖小鼠和人类的下丘脑中存在着不明显的未折叠蛋白反应(UPR)和升高的炎症标志物,此外他们还发现肥胖会引发下丘脑炎症,导致下丘脑IRE1α-XBP1 UPR分支受损,这一分支对于保护下丘脑内分泌功能和防止NAFLD进展至关重要。令人惊讶的是,下丘脑IRE1α缺失会导致甲状腺功能减退,并抑制肝脏中由THRB介导的Xbp1激活。相反,激活肝脏中的THRB-XBP1轴可以改善下丘脑UPR缺陷小鼠的NAFLD。相关研究结果提供了肥胖导致的下丘脑细胞缺陷的首个证据和NAFLD进展中下丘脑-肝脏UPR通讯的病理生理作用。
垂体是控制全身激素、炎症、代谢和能量稳态的中枢内分泌器官,在肥胖中,所有这些都会被破坏,而肥胖是非酒精性脂肪肝病(NAFLD)的主要风险因素。值得注意的是,下丘脑功能减退、生长激素缺乏和甲状腺功能减退患者中非酒精性脂肪性肝病(NAFLD)的患病率较高。众所周知,垂体激素的分泌受下丘脑神经内分泌输入信号的控制,肥胖相关的下丘脑细胞功能障碍导致肝脏糖脂代谢缺陷。然而,肥胖对垂体的直接影响目前仍知之甚少。垂体有自己的自主调控程序,并根据发育和生理挑战进行动态重编程。目前,肥胖背景下的垂体细胞可塑性尚不清楚,并且NAFLD进展中垂体依赖性机制的直接证据有限。
【2】Nat Med:肥胖会因 RalA 激活而导致白色脂肪细胞线粒体破碎和功能障碍
doi: 10.1038/s42255-024-00978-0
肥胖已成为一种世界性流行病,大大增加了 2 型糖尿病、非酒精性脂肪性肝炎和其他心脏代谢异常的发病率。在肥胖的发展过程中,白色脂肪组织(WAT)长期扩张,并发生以激素不敏感、炎症、纤维化和细胞凋亡为特征的新陈代谢变化。线粒体在健康脂肪细胞中发挥着重要的代谢作用,肥胖者的脂肪细胞中线粒体含量比瘦弱者少。此外,肥胖者肌肉中的线粒体也支离破碎,因此其线粒体功能会受损,然而,线粒体损伤的驱动因素及其如何导致肥胖症及其多种并发症仍是未知数。
近日,一篇发表在国际杂志Nature Medicine上题为“Obesity causes mitochondrial fragmentation and dysfunction in white adipocytes due to RalA activation”的研究报告中,来自加利福尼亚大学圣迭戈分校等机构的科学家们通过研究发现,肥胖小鼠集体脂肪细胞中RalA基因和蛋白表达及活性的增加,在白色脂肪细胞(而非棕色脂肪细胞)中靶向缺失 Rala 可减轻高频分解诱导的肥胖,旨在揭示肥胖症患者体内 RalA 的持续升高会导致白色脂肪细胞线粒体功能障碍,并对全身代谢产生深远影响。
结果显示,啮齿动物摄入高氟日粮后,白色脂肪细胞中的 RalA 会被诱导和激活,而 RalA 的负调控因子 RalGAP 则会被下调。在肥胖症患者的脂肪组织中,RalGEF RGL2 的表达与体重指数呈正相关。在白色脂肪细胞中靶向删除 RalA 可防止肥胖依赖的线粒体破碎,并通过增加能量消耗产生对高密度脂蛋白诱导的体重增加有抵抗力的小鼠。体外研究显示,RalA 通过逆转线粒体裂变蛋白 Drp1 的抑制性磷酸化,增加裂变,从而抑制脂肪细胞中线粒体的氧化功能。
【3】Health Data Sci:中国科学家发现肥胖或会导致大脑缩小、白质病变增加
doi:10.34133/hds.0087
近日,一篇发表在国际杂志Health Data Science上题为“Association between Body Mass Index and Brain Health in Adults:A 16-Year Population-Based Cohort and Mendelian Randomization Study”的研究报告中,来自首都医科大学等机构的科学家们通过研究发现,较高的累计体重指数,会导致大脑灰质体积缩小,增加白质病变体积,以及导致微结构完整性异常,且存在因果关系。对于小于45岁的人,累计BMI>26.2,大脑体积的变化相当于大脑衰老了12年。

中国科学家发现肥胖或会导致大脑缩小 白质病变增加
图片来源:Health Data Science(2024)doi:10.34133/hds.0087
在这项研究中,研究人员分析了开滦研究的多模态医学成像研究(META-KLS)中1074名中国成年参与者,年龄在25-83岁之间,对参与者16年的BMI轨迹进行了建模,计算出了累计BMI,用BMI总和除以随访年数,并收集了神经影像数据,分析了累计BMI对大脑的影响。此外,还通过681275名个体的BMI遗传数据和33224名个体的神经影像遗传数据,进行了双样本孟德尔随机化分析,分析了因果关系。
队列研究显示,累积BMI较高,与较小的脑实质体积、灰质体积相关,还与较大的白质病变体积有关。对应的变化分别为,脑实质体积缩小8.99 ml,灰质体积缩小7.49 ml,脑脊液体积增加8.99 ml。
【4】BMC Med:近60万数据荟萃分析显示:肥胖真的导致癌症,至少13种!
doi: 10.1186/s12916-023-03114-z
随着现代生活方式的改变,肥胖已经成为全球范围内的流行病。近几十年来,全球超重和肥胖的患病率逐年攀升,从1975年的20%上升到2016年的39%以上[1]。而且越来越多的研究表明,超重和肥胖是乳腺癌(绝经后妇女)、结直肠癌、胆囊癌、肾癌、肝癌等至少13种癌症的危险因素。[2]因此,我们有必要深入了解肥胖与癌症之间的联系,以便更好地预防和管理这两种疾病。
近日,一篇发表在国际杂志BMC Medicine上题为“Body mass index and cancer risk among adults with and without cardiometabolic diseases: evidence from the EPIC and UK Biobank prospective cohort studies”的研究报告中,来自法国国际癌症研究中心等机构的科学家们对两项前瞻性队列研究的参与者进行荟萃分析,结果发现,无论是否患有心脏代谢疾病,较高身体质a量指数(body mass index, BMI)都会增加欧洲成年人患肥胖相关癌症的风险。此外,肥胖与心血管疾病之间的相互作用表明,与一般人群相比,心血管疾病患者预防肥胖将大大降低患癌风险。
该研究纳入了英国生物样本库 (UKB)和欧洲癌症和营养前瞻性调查(EPIC)两项前瞻性队列研究的参与者。英国生物样本库在英格兰、苏格兰和威尔士招募了约50万名40-69岁的参与人员。欧洲癌症和营养前瞻性调查也招募了来自10个欧洲国家的52万名成年人。首先,作者利用Cox比例风险回归来分析与肥胖相关癌症和所有癌症的关联,Cox比例风险回归是生存分析中最重要的多因素分析方法,可以分析多个因素对生存时间的影响,而且允许有截尾数据存在,多用于不能采用多重线性回归、不服从正态分布的多变量分析。
【5】Nature:揭示肥胖-癌症之间的关联或有望帮助开发改善癌症免疫疗法疗效的新型策略
doi:10.1038/s41586-024-07529-3
近日,一篇发表在国际杂志Nature上题为“Obesity induces PD-1 on macrophages to suppress anti-tumour immunity”的研究报告中,来自范德堡大学医学中心等机构的科学家们通过研究发现,称之为巨噬细胞的免疫细胞在肥胖与癌症之间复杂相互关系中发挥着意想不到的作用。
肥胖会增加肿瘤中巨噬细胞的出现频率并诱导免疫检查点蛋白PD-1的表达,PD-1是癌症免疫疗法的主要作用靶点,该研究揭示了肥胖如何可能加剧癌症风险并同时提升对免疫疗法响应的潜在机制,为进一步优化免疫治疗策略提供了洞见,并指明了可能对此类治疗反应最佳的特定患者群体。
Jeffrey Rathmell博士指出,肥胖作为仅次于吸烟的可调控癌症风险因子,其对个体的影响显得矛盾:既增加了癌症风险,却又似乎提升了对免疫疗法的正面反应。这便是所谓的“肥胖悖论”。为了探究这一现象,研究团队深入分析了肥胖对癌症进程的影响,并聚焦于其在免疫疗法反应中所扮演的双重角色。实验中小鼠模型的数据显示,肥胖小鼠与瘦小鼠肿瘤中提取的巨噬细胞存在显著差异。尽管PD-1传统上被认为是T细胞上的免疫治疗靶标,但研究却发现肥胖小鼠肿瘤衍生的巨噬细胞异常高表达了PD-1,且该蛋白直接作用于巨噬细胞,抑制了它们的正常功能。
【6】Nat Commun:揭示肥胖诱导的机体炎症和代谢功能异常背后的特殊细胞机制
doi:10.1038/s41467-024-47108-8
脂肪组织(AT,Adipose tissue)能以一种复杂的过程适应营养过剩,在这一过程中,特殊的免疫细胞会移除并利用新的脂肪细胞来待提供功能异常和处于压力状态下的脂肪细胞;在被招募到脂肪组织中的免疫细胞中,脂质相关巨噬细胞(LAMs,lipid-associated macrophages)已经成为肥胖和涉及脂质压力和炎症的疾病中的关键参与者。
近日,一篇发表在国际杂志Nature Communications上题为“TM4SF19-mediated control of lysosomal activity in macrophages contributes to obesity-induced inflammation and metabolic dysfunction”的研究报告中,来自韩国首尔大学等机构的科学家们通过研究成功揭示了与肥胖相关的组织中炎症发生及代谢功能障碍背后的分子机制。
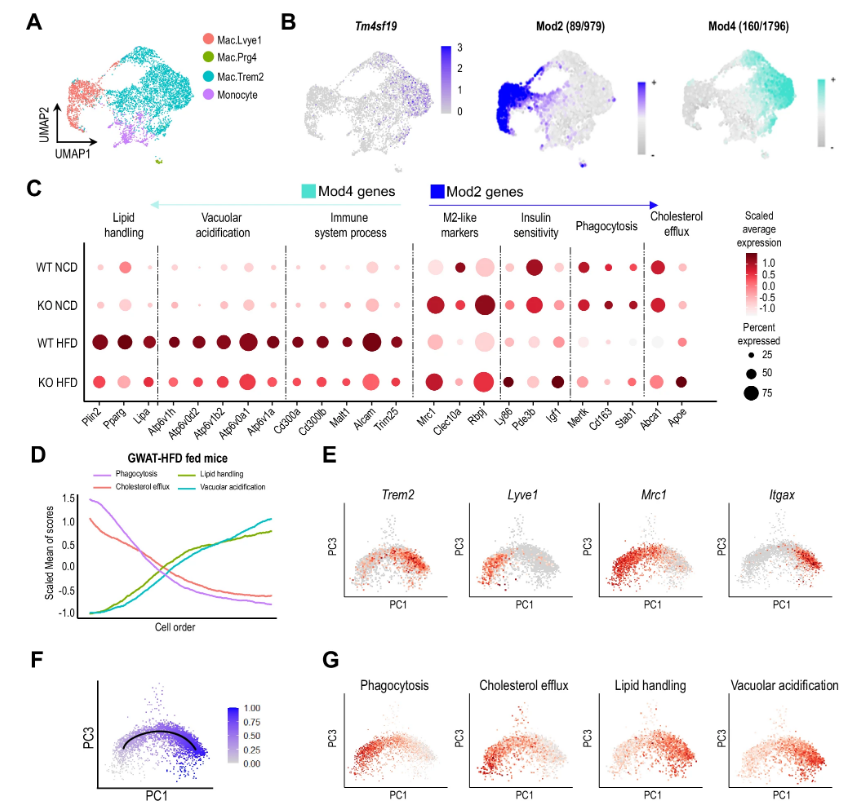
揭示肥胖诱导的机体炎症和代谢功能异常背后的特殊细胞机制
图片来源:Nature Communications (2024). DOI:10.1038/s41467-024-47108-8
据世界卫生组织数据显示,截至2022年,全球大约有16%的人群处于肥胖状态,这种流行病是世界范围内升级最为迅速的一种疾病,也是引起诸如糖尿病、高血压和动脉粥样硬化等多种人类代谢性疾病发生的主要原因。营养物质的过度消耗会促进多种类型巨噬细胞浸润到脂质组织中,其中,某些巨噬细胞在清除死亡细胞和维持组织平衡过程中扮演着重要角色,而另一些巨噬细胞则会引发炎性反应;在肥胖人群中,这些炎性巨噬细胞群的数量会迅速增加,从而就会加速与炎症和代谢功能相关的问题发生。
【7】Nat Cardiovasc Res:科学家揭示人类肥胖和心力衰竭发生之间的神秘关联
doi:10.1038/s44161-024-00516-x
近日,一篇发表在国际杂志Nature Cardiovascular Research上题为“Myocardial ultrastructure of human heart failure with preserved ejection fraction”的研究报告中,来自约翰霍普金斯大学等机构的科学家们揭示了肥胖如何改变一种特殊类型的心力衰竭——保留射血分数的心力衰竭(HFpEF)的肌肉结构。
HFpEF占全球心力衰竭病例的一半以上,在美国,每年因此导致的心力衰竭案例超过350万。最初,这种心脏病形式与高血压有关,随后患者机体会发生过量的肌肉生长(肥大,hypertrophy)。近20年来,HFpEF频繁出现在严重肥胖和糖尿病患者中,但至今缺乏有效的针对性治疗。开发新型疗法的关键障碍在于对人类心脏组织的深入理解不足,仍不能识别到底是哪些具体结构出现了异常。鉴于HFpEF患者的住院率和五年内高达30%-40%的死亡率,理解病因变得尤为迫切。
医学博士David Kass强调,HFpEF(心衰伴保留射血分数)是一个错综复杂的健康状况,它牵涉到多个器官的功能失调,患者的体验与心脏功能衰退的症状极为相似。然而,HFpEF的独特之处在于,患者的心脏泵血能力并未受损,问题出在其他方面,导致了心力衰竭的表现。以往尝试用常规的心力衰竭药物来控制HFpEF往往收效甚微,但令人鼓舞的是,原本用于治疗糖尿病和肥胖的药物在这一领域展现了积极的疗效。
【8】PNAS:中国科学家揭示肥胖通过肠道细菌促进癌症发展 有望启发癌症治疗新思路
doi: 10.1073/pnas.2306776121
随着高脂饮食(HFD)的盛行,全球肥胖率正在快速攀升,与此趋势一致的是,癌症发病率也在逐年增加。高脂饮食(HFD)和肥胖现如今被认为是一些癌症的关键但可改变的危险因素,包括乳腺癌、黑色素瘤和肝癌。值得注意的是,已经有研究表明,高脂饮食通过破坏肠道微生物群而成为诱导癌症发展的高危因素。然而,高脂饮食相关肠道微生物群在癌症发生发展中的具体分子机制尚不清楚。
近日,一篇发表在国际杂志PNAS上题为“A high-fat diet promotes cancer progression by inducing gut microbiota-mediated leucine production and PMN-MDSC differentiation”的研究报告中,来自中山大学孙逸仙纪念医院等机构的科学家们通过研究发现了高脂饮食、肠道细菌和乳腺癌之间存在的密切联系:高脂饮食会增加肠道中脱硫弧菌属(Desulfovibrio)的数量,这类肠道细菌会抑制宿主免疫系统,加速乳腺癌、黑色素瘤等恶性肿瘤的进展或复发。这一发现可能会启发乳腺癌等癌症的全新治疗思路。
膳食脂肪相关的肥胖与绝经后女性的乳腺癌发展有关,大约30%的女性乳腺癌可以通过体重控制来预防,这表明肥胖在肿瘤发生中发挥重要作用。值得注意的是,高脂饮食会影响肠道生态、改变免疫微环境,导致异常的肠道微生物群增多、代谢紊乱和慢性亚临床炎症。
【9】Nat Mental Health:中国科学家揭示肥胖增加多种大脑相关疾病风险
doi:10.1038/s44220-023-00158-1
神经和精神疾病是全球范围内导致残疾和死亡的主要原因之一。研究潜在的风险因素及其潜在机制或相关生理反应可能有助于降低这些疾病的发生率。体重与多种神经和精神疾病之间的关联越来越受到关注。然而,之前的探索体重变化与中风、痴呆和抑郁风险之间的关联的研究结果不一致。
近日,一篇发表在国际杂志Nature Mental Health上题为“Body weight in neurological and psychiatric disorders: a large prospective cohort study”的研究报告中,来自复旦大学附属华山医院等机构的科学家们通过研究表明,肥胖增加了中风、焦虑、抑郁和睡眠障碍这几种神经和精神疾病的风险。
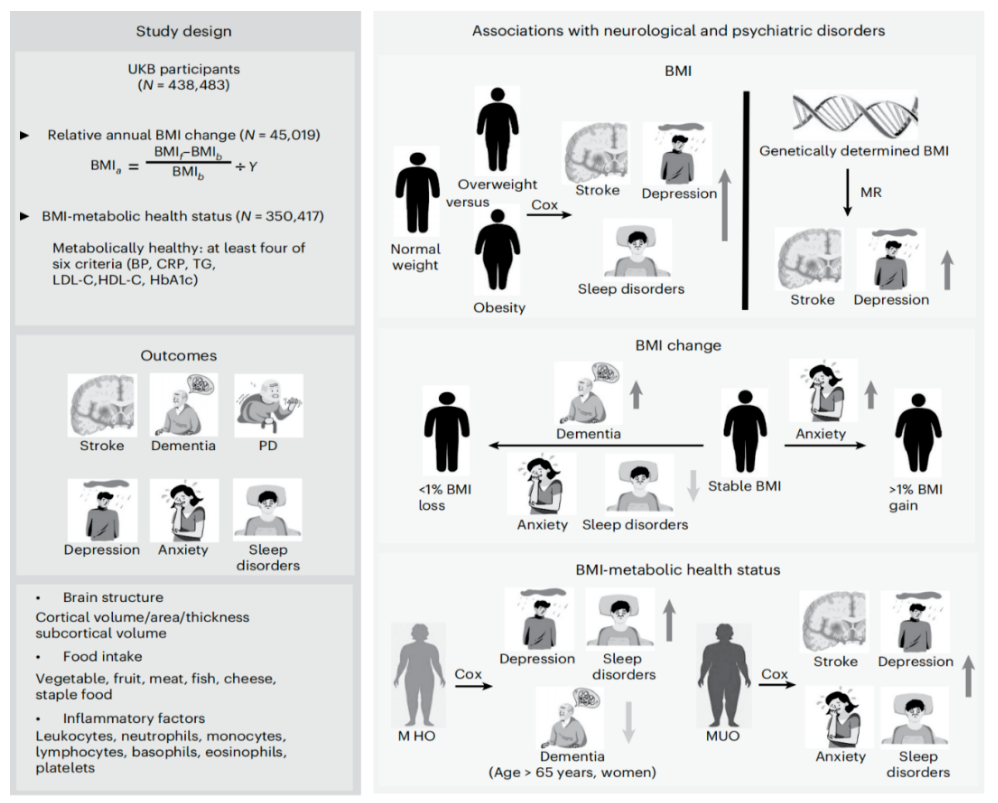
中国科学家揭示肥胖增加多种大脑相关疾病风险
图片来源:Nature Mental Health(2024)doi:10.1038/s44220-023-00158-1
其中,代谢健康型肥胖(MHO)的人群表现出更高的抑郁症和睡眠障碍风险,而代谢不健康型肥胖(MUO)的人群则表现出中风、焦虑、抑郁和睡眠障碍的最高风险。因此,研究团队建议所有肥胖者应进行体重管理,以降低他们患神经和精神疾病的风险。在这项研究中,研究团队使用了英国生物样本库(UK Biobank)中的438483名参与者,旨在了解体重指数(BMI)、BMI变化和BMI-代谢健康状况对常见神经和精神疾病发病率的影响。研究团队使用Cox回归模型分析了体重与六种神经和精神疾病(中风、痴呆、帕金森病、焦虑、抑郁和睡眠障碍)的关联,并进一步探索了其潜在机制。
【10】PLoS Biol:肥胖或会通过胰岛素抵抗与神经变性疾病发生关联
doi:10.1371/journal.pbio.3002359
肥胖会显著增加机体患神经变性疾病的风险,然而这种关联背后的确切分子机制,研究人员并不清楚。近日,一篇发表在国际杂志PLoS Biology上题为“Diet-induced glial insulin resistance impairs the clearance of neuronal debris in Drosophila brain”的研究报告中,来自Fred Hutchinson癌症研究中心等机构的科学家们通过研究发现了肥胖和神经变性疾病(比如阿尔兹海默病)之间的特殊关联。
利用普通果蝇进行研究后,研究人员发现,高糖饮食(肥胖的标志)或会引起大脑中的胰岛素抵抗,从而就会降低大脑清除神经元碎片的能力,并会增加机体发生神经变性的风险;相关研究结果有望帮助研究人员开发出降低机体患神经变性疾病风险的新型疗法。尽管肥胖被认为是诸如阿尔兹海默病和帕金森疾病的一种风险因素,但究竟一种疾病如何诱发另一种疾病,对于研究人员而言仍然是一个谜。
这项研究中,研究人员重点是利用人类和果蝇之间的相似性来回答这个问题,此前研究人员已经发现,高糖饮食会导致果蝇周围器官发生胰岛素抵抗,如今他们转向研究果蝇的大脑,具体而言,他们分析了果蝇机体的神经胶质细胞,因为已知小胶质细胞的功能异常会导致机体神经变性发生。蛋白质PI3k(胰岛素受体信号的下游效应物)的水平或许就能揭示细胞对胰岛素的反应有多大,如今研究人员发现,高糖饮食会导致神经胶质细胞中PI3k水平降低,这就揭示了胰岛素抵抗的存在,同时他们还观察了果蝇机体中称之为鞘神经胶质细胞(ensheathing glia)的小胶质细胞,其主要功能就是清除神经碎片,比如退化的轴突等。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


