摘取“KRAS”圣杯!国家药监局授予安进sotorasib突破性药物资格:治疗KRAS G12C突变肺癌!
来源:本站原创 2021-01-30 18:30
sotorasib将成为第一个获批治疗KRAS G12C突变晚期NSCLC的靶向疗法。

2021年01月30日/生物谷BIOON/--安进(AMGEN)近日宣布,其KRASG12C抑制剂sotorasib获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)授予突破性治疗药物资格。
突破性治疗药物资格认定是为了加快开发针对严重疾病、且已在前期临床试验中显示疗效或安全性方面显著优于现有治疗手段的新药而设计的。获得突破性治疗药物认定能够使该药获得CDE快速审评待遇,而且能与CDE密切交流、获得指导,从而加快新药上市,更早解决中国病患未满足的临床需求。同期获批的还有武田、阿斯利康等制药企业。
sotorasib是一种KRASG12C抑制剂,目前已在美欧进入审查,用于治疗先前已接受过治疗的KRAS G12C突变、局部晚期或转移性NSCLC成人患者。在美国,FDA已授予sotorasib突破性药物资格。
非小细胞肺癌(NSCLC)是最常见的肺癌,约占全球肺癌病例的80-85%。KRAS G12C是NSCLC中最常见的KRAS突变,该突变是中国NSCLC患者预后不良的生物标志物。研究表明,大约3-5%的NSCLC患者有KRAS G12C突变,这种突变在吸烟者中最常见。
安进研发执行副总裁David M.Reese医学博士表示:“鉴于突破性治疗药物资格在中国是一条新的途径,我们很高兴收到sotorasib的这一资格认定,这强调了sotorasib的重要性。我们期待着与中国监管机构合作,为KRAS G12C突变的非小细胞肺癌患者带来首个潜在的靶向治疗。”
sotorasib突破性药物资格,得到了CodeBreaK 100 2期临床试验阳性结果的支持。该研究在先前接受过化疗和/或免疫治疗但癌症仍有进展的晚期NSCLC患者中开展。在这项研究中,sotorasib治疗显示出持久的抗癌活性,具有积极的获益风险特征:确认的客观缓解率(ORR)为37.1%、疾病控制率(DCR)为80.6%、中位缓解持续时间(DOR)为10个月。
这些结果已于1月29日在由国际肺癌研究协会主办的2020年第21届世界肺癌大会(WCLC)主席研讨会上发表。(详见:摘取“KRAS”圣杯!安进sotorasib治疗KRAS G12C突变肺癌(NSCLC)疗效强劲:疾病控制率80.6%!)
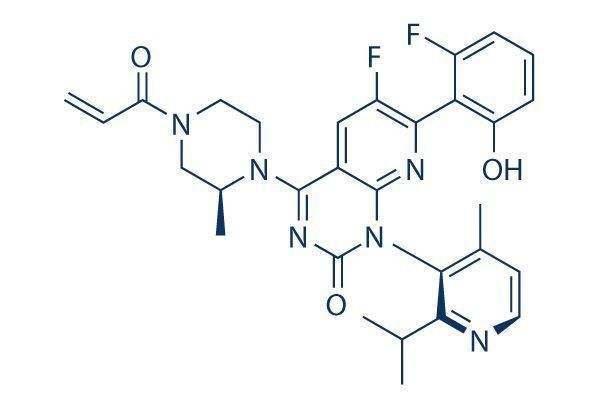
sotorasib(AMG510)化学结构式(图片来源:selleck.cn)
KRAS是被发现的首批癌基因中的一种,其突变存在于大约1/4的人类肿瘤中,是肿瘤学药物研发领域最明确的靶标之一。然而遗憾的是,尽管前景很好,但KRAS长期以来几乎无法攻克,这是由于该蛋白是一种无特征、近乎球形的结构,无明显的结合位点,很难合成一种能靶向结合并抑制期活性的化合物。目前,KRAS已成为肿瘤药研发领域“不可成药”靶标的代名词。
sotorasib(AMG 510)是成功靶向KRAS并进入人体临床开发的首批小分子抑制剂之一,可靶向抑制携带G12C突变的KRAS蛋白。sotorasib通过将G12C突变KRAS蛋白锁定在一种非激活GDP结合状态来特异性地和不可逆地抑制其促增殖活性。
通过开发sotorasib,安进承接了过去40年来癌症研究中最严峻的挑战之一。sotorasib是第一个进入临床的KRASG12C抑制剂,目前正在进行一项最广泛的临床项目CodeBreaK,在全球五大洲探索10种药物组合。在短短2年多的时间里,CodeBreaK项目还建立了最深入、迄今为止最大规模的的临床数据集,对13种肿瘤类型的700多例患者进行了研究。(生物谷Bioon.com)
原文出处:Amgen Announces Breakthrough Therapy Designation Granted For Sotorasib In China
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


