研究阐述V(D)J重排中RAG细胞周期性调控的分子机理
来源:北大 2021-10-17 12:37
脊椎动物的B淋巴细胞和T淋巴细胞在发育过程中会通过V(D)J重排产生多样化的细胞表面受体来识别外来抗原,参与机体的适应性免疫过程。这些在基因组上串联分布的V、D、J片段两端带有重组信号序列(Recombination signal sequences , RSSs),可以被淋巴细胞中特异表达的重排酶RAG复合物识别并切割产
脊椎动物的B淋巴细胞和T淋巴细胞在发育过程中会通过V(D)J重排产生多样化的细胞表面受体来识别外来抗原,参与机体的适应性免疫过程。这些在基因组上串联分布的V、D、J片段两端带有重组信号序列(Recombination signal sequences , RSSs),可以被淋巴细胞中特异表达的重排酶RAG复合物识别并切割产生DNA双链断裂(Double strand break, DSB),在细胞的非同源末端链接(Non-homologous end joining,NHEJ)修复通路下,不同的V、D、J片段被连接起来从而产生多样化的细胞表面受体1。重排酶RAG是由重组激活基因(Recombination activating genes,RAGs)编码的RAG1和RAG2两个蛋白质组成,它们以复合物的形式靶向基因组中的RSS序列从而发挥V(D)J重排功能。其中,RAG1含有核酸酶活性,是催化活性中心;而RAG2无明确的蛋白质功能域,但可以将RAG1的活性提高数百到数千倍2-3。由于RAG复合物会在基因组中产生DSB,因此细胞将通过一定方式控制RAG复合物的功能活性以保证细胞中的基因组稳定性。已有的研究表明,RAG2的表达受到细胞周期的调控,其只在G1期表达而在进入S期后就快速降解,因此淋巴细胞中只有在G1时期才会发生VDJ重排过程4-5。而RAG2如何调控RAG1,以及细胞为何选择降解RAG2而不是RAG1和RAG2,都是待解决的问题。
北京大学生命科学学院和北大-清华生命科学联合中心胡家志研究员课题组在Cell Reports发表了题为“RAG2 abolishes RAG1 aggregation to facilitate V(D)J recombination”的研究论文,系统性地阐述了在细胞周期中RAG2是如何调控RAG1的凝聚从而调控RAG1在细胞内的重排酶活性的,并且从进化的角度阐述了脊椎动物中RAG1和RAG2共进化的生物学意义。
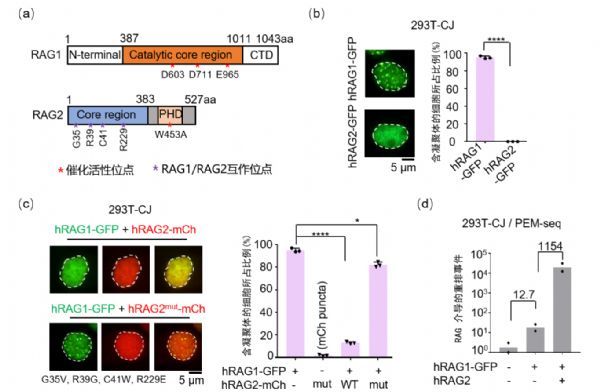
该研究通过表达以及内源荧光标记方式在多种细胞系中利用共聚焦成像技术观察并证明了人RAG1蛋白而不是RAG2在细胞核内形成凝聚体的现象(图1a-b);进一步的研究发现,RAG2的存在可以破坏RAG1的凝聚状态(图1c)。研究人员接着利用实验室2019年开发的PEM-seq高通量测序方法,在整合了RSS序列的293T细胞中检测了凝聚状态和游离状态的RAG1活性。测序结果显示,凝聚态的RAG1几乎不能介导V(D)J重排,相反游离态的RAG1的重排酶活性增加了1154倍(图1d)。当利用RNA结合蛋白FUS迫使RAG1一直以凝聚体形式存在时,其重排酶活性也会被抑制。这表明细胞内RAG1的重排酶活性是受到自身凝聚体状态的调控的,这也能很好地阐述发育中的淋巴细胞在G1周期之外如何保护自身基因组的完整性。为了进一步研究RAG1凝聚体形成机制,研究人员进行了一系类氨基酸功能位点的突变(图1a),发现RAG1蛋白的催化活性中核心氨基酸DDE和位于蛋白质N端核定位信号对其产生凝聚作用发挥了重要的作用。此外,该研究还发现RAG2是通过与RAG1直接的相互作用来破坏RAG1自身的凝聚状态,而不依赖RAG2的PHD功能域(图1c)。
研究人员还从进化角度探究了不同脊椎动物的RAG2蛋白对于人源RAG1凝聚体调控的普适性。结果发现只有人源的RAG2能够最大程度地破坏RAG1的凝聚状态从而起始VDJ重排活性,来自小鼠的RAG2只能恢复很弱的功能,而来自斑马鱼的RAG2则不能调控人源RAG1的凝聚状态(图2),表明了RAG2的起源可能跟RAG1一样早,两者共同进化,因此在物种之间表现出了一些不同的性质。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。