科学家在细胞外囊泡研究领域取得的新进展!
来源:本站原创 2022-01-27 18:17
细胞外囊泡(EVs)是细胞主动释放的纳米级膜囊泡,基于其生物发生、大小和生物物理性质,可以进一步分类,例如外泌体和微泡等。尽管最初七被认为是细胞碎片,并且因此被低估,但如今EVs越来越被认为是细胞间通讯、疾病诊断和预后循环生物标志物的重要载体。本文中,小编就整理了多篇重要研究成果,共同解读科学家们在细胞外囊泡研究领域取得的新成果!分享给大家!【1】J Ext
细胞外囊泡(EVs)是细胞主动释放的纳米级膜囊泡,基于其生物发生、大小和生物物理性质,可以进一步分类,例如外泌体和微泡等。尽管最初七被认为是细胞碎片,并且因此被低估,但如今EVs越来越被认为是细胞间通讯、疾病诊断和预后循环生物标志物的重要载体。本文中,小编就整理了多篇重要研究成果,共同解读科学家们在细胞外囊泡研究领域取得的新成果!分享给大家!
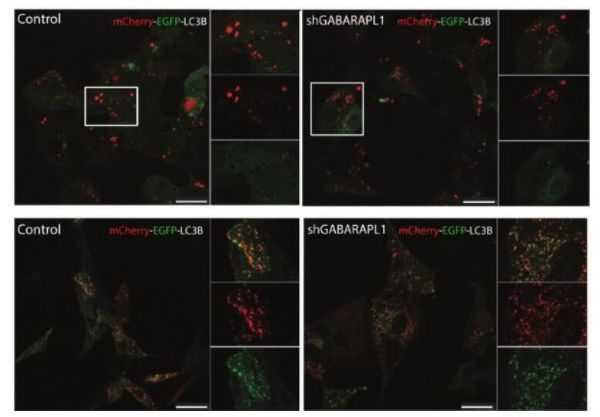
MCherry-EGFP-LC3B表达细胞的共聚焦显微镜观察
图片来源: https://doi.org/10.1002/jev2.12166
【1】J Extracell Vesicles: 缺氧时促血管生成细胞外囊泡的分泌依赖于自噬相关蛋白GABARAPL1
doi:10.1002/jev2.12166
肿瘤缺氧是实体肿瘤的一个标志,与肿瘤进展、转移发展和治疗抵抗有关。作为对缺氧的反应,肿瘤细胞分泌促血管生成因子,诱导血管形成,恢复缺氧区域的氧气供应。细胞外小泡(EVS)是肿瘤微环境中细胞间通讯的媒介。在这里,作者证明了LC3/GABARAP蛋白家族成员GABARAPL1的表达增加是内体成熟、分选到内体和肠病毒分泌所必需的。
GABARAPL1是GABARAP蛋白家族的成员,GABARAP蛋白家族是一组蛋白质,通过介导重要的细胞过程,如自噬和受体向质膜的运输,促进细胞内环境的稳定。作为LC3/GABARAP蛋白家族的成员,GABARAPL1被认为在自噬的一般执行过程中发挥作用。作者意外地观察到GABARAPL1对于(宏)自噬的一般执行不是必需的。
顺理成章的是,最近的研究表明GABARAPL1可能更多地参与了选择性形式的自噬。然而,GABARAP蛋白在执行自噬过程中的功能冗余已经被描述,并可能解释为什么沉默GABARAPL1对自噬活性的影响可以忽略不计。
在这项研究中,作者描述了GABARAPL1在缺氧时需要分泌EVS和生长因子,从而促进了不同类型肿瘤细胞的生长。此外,作者还证明了GABARAPL1和GABARAP在较小范围内的表达,而不是GABARAPL2的表达,强调了不同的GABARAP家族成员的独特功能。
【2】eLife:肿瘤衍生的胞外囊泡如何通过抑制性免疫受体来调节肿瘤浸润性调节性T细胞的功能?
doi:10.7554/eLife.61999
来自免疫系统中称之为CD4+ 调节性T细胞(Treg)的免疫细胞或与肿瘤的预后直接相关,肿瘤中存在越多的Treg细胞,患者的预后就越差;此前研究者从研究中得知,Treg细胞能浸润到肿瘤微环境中,并在那里抑制抗肿瘤免疫力,即机体为抵御癌细胞而设置的一种自我防御性机制,从而来刺激肿瘤生长;然而,目前研究人员并不清楚肿瘤浸润性Treg细胞是如何被激活和被调节的,更好地理解Treg细胞促进肿瘤生长的机制或许有望帮助设计治疗黑色素瘤和其它癌症的新型疗法。
近日,一篇发表在国际杂志eLife上题为“Tumor-derived extracellular vesicles regulate tumor-infiltrating regulatory T cells via the inhibitory immunoreceptor CD300a”的研究报告中,来自日本筑波大学等机构的科学家们通过研究揭示了一种新型机制,即衍生自细胞中的小颗粒如何调节肿瘤浸润性的Treg细胞。
细胞外囊泡(EVs)是由于细胞所释放的颗粒,其被含有功能性大分子(蛋白质、脂质和核酸)的脂质双层所限定,并能被转移到其它细胞中;来自肿瘤细胞的EVs能充当信使并正在成为肿瘤进展和转移发生过程中的关键角色。研究者Akira Shibuya表示,我们发现,树突细胞表面上缺失抑制性免疫受体CD300a的小鼠机体在移植了B16黑色素瘤后,相比野生型小鼠而言,其机体肿瘤中的Treg细胞水平会增加,而且肿瘤也生长地较快。
如果CD300a受体的缺失会导致Treg细胞水平的增加,那么研究者就可以得出结论揭示其关联性,而下一步研究人员就要理解其中的具体机制了。通过研究来自黑色素瘤的细胞,研究人员发现,肿瘤衍生的胞外囊泡结构或许就是他们正在寻找的关联,此外,其还能与树突细胞表面名为CD300a的抑制性免疫受体相结合,从而就会阻断IFN-β的产生,IFN-β是一种能激活Treg细胞的分子,因此,通过结合CD300a,胞外囊泡就会抑制肿瘤浸润性Treg细胞的激活以及肿瘤的发生。
【3】JEV:小细胞外囊泡来源的miR-574-5p通过TLR/调控肺癌中PGE的生物合成
doi:10.1002/jev2.12143
细胞间通讯在肺癌(LC)中起重要作用。细胞间通讯的主要参与者之一是细胞外小泡(sEV)。SEV通过将细胞货物运输到靶细胞引发各种生物反应。sEV的一个重要组成部分是microrna (miRs),其转运最近引起了越来越多的研究兴趣。作者报道了前列腺素E2 (PGE2),一种关键的炎症脂质介质,可特异性诱导A549和2106T细胞sEV中miR-574-5p的分选。
作者发现,sev衍生的miR-574-5p激活toll样受体(TLR) 7/8,从而降低pge2水平。相反,细胞内miR- 574-5p可诱导pge2生物合成。因此,细胞内和 sEV 衍生的 miR-574-5p 的组合通过反馈回路控制 PGE2 水平。这只在腺癌中观察到,而在鳞状细胞癌中没有,这表明细胞对sev衍生的miRs有特异性反应,这可能是由于独特的四倍体蛋白组成。因此,作者描述了一种腺癌特有的miR-574-5p的新功能。细胞内miR-574-5p诱导PGE2,从而分泌sev来源的miR-574-5p,从而降低受体细胞中PGE2的生物合成。
肺癌(LC)是全球最常见的癌症相关死亡原因。非小细胞肺癌(NSCLC)是最常见的LC类型,约占所有病例的80%。大多数nsclc与前列腺素E2 (PGE2)过表达有关,PGE2是一种由两个顺序反应形成的生物活性脂质介质。首先,环氧合酶COX-1和COX-2将花生四烯酸转化为前列腺素H2 (PGH2)。然后,PGH2被末端酶微粒体前列腺素E合成酶1 (mPGES-1)加工成PGE2。一些研究已经观察到PGE2的肿瘤促进作用。
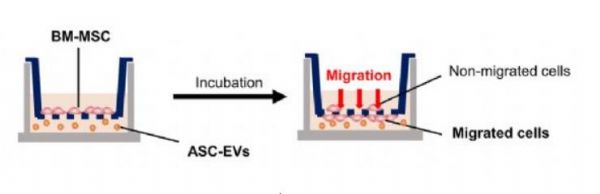
Transwell 迁移测定的示意图。
图片来源:https://doi.org/10.1002/jev2.12152
【4】JEV:脂肪组织来源的干细胞细胞外囊泡通过骨保护素和miR-21-5p缓解骨质疏松症
doi:10.1002/jev2.12152
骨质疏松症是一种常见的骨骼疾病,是由于骨形成与骨吸收之间的不平衡,导致骨组织数量的损失。干细胞源性细胞外囊泡(EVs)作为一种新型的无细胞治疗方法,由于其优于亲代干细胞而受到越来越多的关注,因此本文对脂肪组织源性干细胞(ASC-EVs)在骨质疏松发病中的治疗作用进行了研究。
ASC-EVs 通过基于切向流过滤 (TFF) 系统的多过滤系统分离,并使用透射电子显微镜、动态光散射、zeta 电位、流式细胞术、细胞因子阵列和酶联免疫吸附测定进行表征。ev富含与骨代谢和间充质干细胞(MSC)迁移相关的生长因子和细胞因子。特别是骨保护素(OPG),一种核因子受体激活因子配体(RANKL)的天然抑制剂,在ASCEVs中高度富集。
作者发现静脉注射asc - ev可减轻骨质疏松小鼠的骨损失。ASC-EVs显著抑制巨噬细胞的破骨细胞分化,促进骨髓源性MSCs (BM-MSCs)的迁移。然而,缺乏OPG的ASC-EVs并没有显示出抗破骨细胞生成的作用,这表明OPG对ASC-EVs的治疗效果至关重要。此外,对小RNA测序数据进行分析,以确定与抗骨质疏松作用相关的候选miRNA。miR- - p在asc - ev中通过下调Acvr抑制破骨细胞分化。同时,let- b- p在asc - ev中显著降低破骨细胞相关基因的表达。最后,静脉注射后,asc - ev到达骨组织,它们停留的时间更长。ASC-EVs中的OPG、miR- p和let- b- p抑制破骨细胞分化,降低骨吸收相关基因表达,提示ASC-EVs作为无细胞治疗骨质疏松的药物非常有前景。
【5】Nat Biomed Eng:利用胞外囊泡或有望帮助治疗人类炎症
doi:10.1038/s41551-021-00792-z
胞外囊泡(EVs,Extracellular vesicles)能够被功能化在细胞表面展示出特定的蛋白质受体,然而,表面展示技术通常只会标记一小部分的EV群体。科学家们希望能利用这些胞外囊泡来在机体内运输药物;近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Amelioration of systemic inflammation via the display of two different decoy protein receptors on extracellular vesicles”的研究报告中,来自瑞典卡罗琳学院等机构的科学家们通过研究发现,这些胞外囊泡(纳米小泡)能在体内帮助运输蛋白质药物,从而降低不同疾病所诱发的炎症,这种技术或在动物模型中展现出了非常有希望的结果。
作为生物信号的运输载体,胞外囊泡在细胞间的交流过程中非常重要,其是由细胞所排出的纳米尺寸大小的膜包被的“包裹”,能将脂肪酸、蛋白质和遗传物质运输到不同的组织中去;这些微小的小泡结构在体液中自然存在,其能通过生物屏障(比如血脑屏障),并被用作治疗性物质的天然载体,因此,胞外囊泡作为潜在的药物如今获得了越来越多的关注。
文章中,研究人员利用生物分子技术,在胞外囊泡的膜上涂抹了治疗性的蛋白,更确切地说,是能结合炎性物质TNF-α和白介素-6(IL 6)的受体;TNF-α和白介素-6是在诸如多发性硬化症和炎性肠病等炎性状况下在机体中形成的,其在炎症和随后的组织损伤过程中扮演着关键作用,这或许就能帮助研究人员开发新型的生物性药物来他通过抑制TNF-α和白介素-6的功能从而减缓机体的炎性反应。
【6】Cell Death and Disease: 细胞外囊泡包裹dsDNA通过激活STING通路加重克罗恩病
doi:10.1038/s41419-021-04101-z
克罗恩病(CD)是一种肠道免疫功能障碍性疾病。胞外囊泡(EVS)是一种被膜包裹的充满功能分子(如核酸)的颗粒。近年来,EV通过实现肠道细胞间的细胞间通讯参与了CD的发生发展。然而,携带双链DNA(DsDNA)的EVS在CD中肠道炎症部位脱落的作用尚未被研究。在这里,作者从小鼠结肠炎和CD患者的血浆或结肠灌洗液中分离出EV。在小鼠结肠炎和活动性人类CD中,外体dsDNA(包括mtDNA和nDNA)水平显著升高,且与疾病活动性呈正相关。此外,CD还证实了STING通路的激活。活化人CD血浆中的EVS在体外可引起巨噬细胞的刺激性激活。来自LPS损伤的结肠上皮细胞的EV也被证明通过激活STING通路来增加巨噬细胞的炎症,但这种作用在去除外体dsDNA后消失。这些发现在STING缺陷的小鼠和巨噬细胞中得到了进一步证实。刺缺乏明显改善结肠炎。此外,还评价了EVS释放抑制剂GW4869的潜在治疗作用。应用GW4869通过抑制STING激活,成功地改善了小鼠结肠炎。综上所述,胞外体dsDNA可通过激活巨噬细胞内的STING通路促进肠道炎症,并可作为CD潜在的机制生物标志物和治疗靶点。
克罗恩病(CD)是一种慢性穿壁性复发性炎症性肠病,与结直肠癌的风险增加有关。由于对其发病机制的认识不完全,目前CD仍是不治之症,通常伴随患者终生,造成巨大的经济负担。在过去的几十年里,有文献表明,免疫反应的失衡,如巨噬细胞中的异常免疫信号,与CD密切相关。有证据表明,CD免疫微环境的破坏主要表现为肠上皮细胞的破坏,使肠上皮细胞成为损伤相关分子模式(Damps)的重要来源。巨噬细胞可以被湿气激活,并表现出一种促炎亚型。探讨肠上皮细胞和巨噬细胞串扰背后的分子机制有助于加深对CD的认识。
近年来,胞外体作为一种富含功能分子的重要细胞通讯载体,已成为生物医学领域研究的热点。胞外体是具有脂质双层结构的30-150 nm的胞外囊泡,由不同的细胞释放,以便将小分子转移到其他细胞。包裹在EVS中的功能分子,包括核酸、脂质和蛋白质,在很大程度上决定了它对受体细胞的影响。广泛的研究表明,EV广泛传播,可以稳定地存在于各种体液中,包括血浆、牛奶和唾液。EVS的易得性和广泛的存在确保了EVS成为一种有效的生物标志物,并暗示其在肿瘤、自身免疫和炎症性疾病等疾病中的调节作用。
【7】JEV:细胞外囊泡中富含lncRNA编码多肽/小蛋白且有疾病特异性
doi:10.1002/jev2.12123
lncRNAs是一类长度大于200个碱基且不编码蛋白的RNAs转录本。近年来,越来越多实验证据表明,许多lncRNAs转录本中的小开放阅读框(small open reading frame,smORFs)可以编码多肽/小蛋白(smORF encoded polypeptides or microproteins),并在细胞Ca2+稳态、代谢和发育、应激信号传导和DNA修复等重要生物学过程中发挥不同的调节作用。有研究发现,与癌症相关的lncRNA及其编码的功能性多肽/小蛋白能够影响肿瘤的发生、侵袭和转移。然而,lncRNA编码多肽/小蛋白在癌症发生、发展中的作用机制仍未得到深入表征,尤其是其可能的作用机制和模式有待进一步探讨。
中国科学院生物物理研究所研究员杨福全团队、中科院院士陈润生团队及北京三博脑科医院教授张宏伟团队在Journal of Extracellular Vesicles上,在线发表了题为LncRNA-encoded microproteins: A new form of cargo in cell culture-derived and circulating extracellular vesicles的研究论文,首次报道了lncRNA编码多肽/小蛋白是一种新的细胞外囊泡内容物。进一步的实验数据显示,血浆EVs中富含lncRNA编码多肽/小蛋白,其组成的差异可用于区分脑胶质瘤患和健康对照。
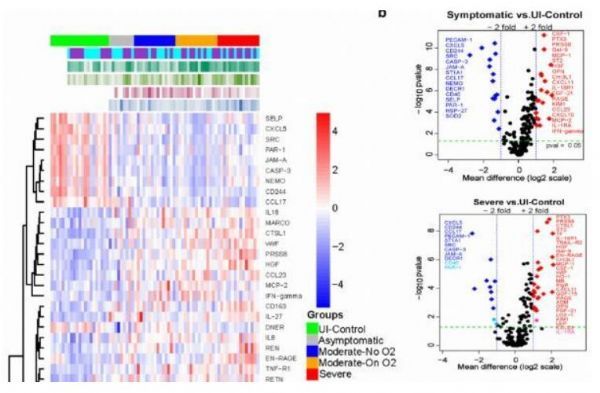
新冠肺炎患者循环SEV的邻近延伸分析
图片来源:https://pubmed.ncbi.nlm.nih.gov/34262673/
【8】JEV:细胞外囊泡介导的内皮细胞凋亡和EV相关蛋白与COVID-19疾病严重程度相关
doi:10.1002/jev2.12117
由新型严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)引起的2019年新冠肺炎(CoronaVirus Disease-2019年)已导致一场全球大流行,感染和死亡人数不断上升。更好地了解其发病机制将极大地改善患者的预后和治疗。在这里,作者比较了84例不同疾病严重程度的SARS-CoV-2住院患者循环中大小细胞外小泡(EV)的炎症和心血管疾病相关蛋白含量。我们的研究结果显示,EVS中的促炎、促凝血、免疫调节和组织塑造蛋白信号显著丰富,这些特征显著区分了有症状的新冠肺炎患者与有匹配合并症的未感染对照组,并区分了中度疾病和危重疾病的患者。其中EN-RAGE与疾病严重程度和住院时间相关性最强,其次为TF和IL-18R1。重要的是,COVID-19患者的ev诱发了肺微血管内皮细胞的凋亡。在新冠肺炎疾病的控制和控制中,作者可以利用这些方法来预测疾病的严重程度、确定患者的住院需求和确定新的治疗靶点,并支持开发基于EV的方法来预测疾病的严重程度、确定患者的住院需求和确定新的治疗靶点,并为开发基于EV的方法奠定基础。这一方法可用于预测疾病的严重程度、确定患者的住院需求和确定新的治疗靶点,并支持开发基于EV的方法来预测疾病的严重程度、确定患者的住院需求和确定新的治疗靶点。
由严重急性呼吸综合征冠状病毒-2 (SARS-CoV-2)引起的冠状病毒病-2019 (COVID-19)以内皮功能障碍和免疫反应失调为特征。与导致2002年和2003年流行病的SARS-CoV病原体一样,SARS-CoV-2通过其刺突蛋白与血管紧张素转换酶2 (ACE2)受体结合进入细胞。ACE2受体在肺泡II型和内皮细胞中大量存在,从而使肺部和肺血管易受sars - cov -2诱导的炎症和损伤。此外,在感染肺的尸检分析中发现了肺泡毛细血管微血栓和内皮损伤,并有细胞内病毒的证据。
尽管越来越多的证据表明,内皮损伤、血管重塑和凝血病是COVID-19感染的关键后果,但尚不清楚病毒如何引发这些变化。细胞外囊泡(EVs)携带蛋白质、编码和非编码RNA、DNA片段和脂质,促进细胞间的相互交流。EV的转运在许多疾病过程中起着重要的作用,包括心血管疾病、肺动脉高压和各种恶性肿瘤。除其他病理生理触发因素外,凝血酶、剪切应力、补体激活和炎症均可释放ev。EV不仅可以通过细胞串音介导疾病,它们的货物也可以作为疾病状态的生物标志物。EV内容物的顺序分析可以提供疾病随时间进展的快照。在这项研究中,作者分析了感染SARS-CoV-2患者血浆来源的EV的变化,以研究EV在新冠肺炎疾病病理生理中可能发挥的作用,并确定潜在的EV生物标志物,以预测新冠肺炎疾病的严重程度和进展。
【9】Nature子刊:口服牛乳来源的细胞外囊泡可诱导原发肿瘤衰老,但加速肿瘤转移
doi:10.1038/s41467-021-24273-8
关于饮食中的细胞外小泡(EV)可以被消耗生物体的肠道吸收,并在各种器官中被生物利用,进而产生表型变化的观点是有很大争议的。在这里,作者从原料和商业牛乳中分离出EV,并通过电子显微镜、纳米颗粒跟踪分析、Western blotting、定量蛋白质组学和小RNA测序分析对其进行表征。口服牛乳来源的EV在小鼠体内能在严酷的肠道降解条件下存活下来,随后在多个器官中被检测到。口服乳源EVS给植入了结直肠癌细胞和乳腺癌细胞的小鼠,可以降低原发肿瘤的负担。有趣的是,尽管原发肿瘤生长减少,但乳源性EV加速了乳腺癌和胰腺癌小鼠模型的转移。蛋白质组学和生化分析显示,乳源EVS治疗可诱导癌细胞衰老和上皮向间充质转化。EV给药的时机至关重要,因为原发肿瘤切除后口服EV可以逆转乳源EV在乳腺癌模型中的促转移作用。综上所述,作者的研究提供了基于上下文的和相反的乳源EV作为肿瘤转移诱导者和抑制者的作用。
摄取的食物rna在宿主生物体中可能是生物可利用的,其调节组织中的基因表达和生物体表型的能力已经点燃了人们对跨王国和跨物种交流的前所未有的兴趣,这一想法已经引起了人们对跨物种交流的前所未有的兴趣。当人血清中高水平的外源植物miR159与乳腺癌的发生和发展呈负相关时,跨物种交流的概念进一步加强。与这一观察结果相印证的是,口服miR159显著降低了异种移植乳腺肿瘤的负担。虽然这些观察结果挑战了现有的范式,并强调饮食rna可以通过食物摄入吸收,在血液中循环,到达不同的器官和调节基因表达,但它也在转基因生物的监管委员会中引发了额外的辩论。然而,这一概念受到了少数几项控制良好的研究的挑战,这些研究强调核酸的不稳定性,这些核酸最终会屈服于哺乳动物胃肠道的膜屏障和核酸酶。此外,由于没有遵守严格的程序,这些观察结果经常被批评为饮食反应性内源性RNA或人工制品。虽然脂质双层胞外囊泡(Evs)被认为是丰富的蛋白质和rn8-11货物的保护者,但通过evs支持跨物种交流的具体体内证据是有限的,因此这一概念仍然存在争议。
【10】Sci Trans Med:啮齿动物羊水干细胞胞外囊泡可挽救胎儿肺发育不全
doi:10.1126/scitranslmed.aax5941
胎儿肺部发育不全是一类常见的先天性疾病,其特征是肺部生长缺陷和成熟度下降。患有肺发育不全的婴儿中最常见的缺陷是先天性疝气(CDH)。尽管近年来研究和临床实践取得了长足的进展,但婴儿的发病率和死亡率仍然很高,这与肺部发育不全的严重程度直接相关。迄今为止,还没有有效的方法可以促进胎儿肺的生长和成熟。
在最近一项研究中,来自多伦多儿童医院的Augusto Zani团队以小鼠的实验对象,描述了一种基于干细胞的治疗方法,相关结果发表在最近的Science Translational Medicine杂志上。
在该研究中,作者首先建立了大鼠的胎儿肺脏发育不全模型,即在怀孕第9.5天给予孕鼠硝基苯酚处理,该药物主要针对视黄酸合成。在该模型中,整个窝的肺部发育不全程度与人类胎儿类似。与未受伤胎儿的肺部相比,硝基苯酚暴露在子宫内会导致胎儿细支气管分裂和空泡域减少。在此基础上,作者将大鼠羊水干细胞外周囊泡——AFSC-EV(平均大小为140±5 nm)处理分离自受损伤孕鼠假腺期(E14.5)收获的增生性肺外植体,表明其可改善分支形态发生。与未经处理的发育不良的肺外植体相比,经AFSC-EV处理的肺外植体的芽数和表面积增加,与健康组对照相似。
除胎儿肺生长受损外,肺发育不全的特征还在于其成熟度受影响,这是子宫暴露于硝基苯酚中的另一特征,表现为发育不良的肺部细胞增殖减少,上皮细胞分化延迟,远端远端祖细胞密度增加和表面活性剂蛋白C(SPC)表达降低。 AFSC-EV给药可挽救细胞增殖并改善上皮细胞分化,表现为降低SOX9 +细胞密度和增加SPC表达。(生物谷Bioon.com)
更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。