T细胞的这些全新功能,你一定不知道!
来源:本站原创 2019-06-14 07:43
2019年6月14日讯 /生物谷BIOON /——T细胞作为免疫系统中的重要组分和效应细胞,在抵抗细菌病毒等外来病原体和杀伤癌细胞等方面扮演着不可或缺的重要角色。因此本文为大家带来近期关于T细胞的最新研究进展,与大家一些学习进步!【1】Nat Immunol:在慢性病毒感染期间,杀伤性T细胞引发恶病质产生DOI:10.1038/s41590-019-0397-y在一项新的研究中,来自奥地利、德国、
2019年6月14日讯 /生物谷BIOON /——T细胞作为免疫系统中的重要组分和效应细胞,在抵抗细菌病毒等外来病原体和杀伤癌细胞等方面扮演着不可或缺的重要角色。因此本文为大家带来近期关于T细胞的最新研究进展,与大家一些学习进步!
在一项新的研究中,来自奥地利、德国、美国和瑞士的研究人员鉴定出病毒感染可导致恶病质的机制。在遭受一种特定病毒感染的小鼠中,杀伤性T细胞引发脂肪组织和体重的减少,不过它们如何做到这一点仍然不清楚。相关研究结果发表在Nature Immunology期刊上。
为了了解感染如何促进恶病质产生,这些研究人员研究了一种业已确定的病毒感染模型:感染淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus, LCMV)的小鼠,这种病毒是一种啮齿动物传播的病原体,也可以感染人类。他们观察到,在接触这种病毒后的一周内,这些小鼠便表现出人类恶病质患者的症状:它们移动得更少,体重减轻了20%,部分肌肉和脂肪组织消失了。
这些研究人员进行了大量实验,以便了解是什么在他们的小鼠模型中促进恶病质产生。他们首先阻断了一些"常见的可疑"蛋白,比如IL-6和TNFα,已知这些蛋白在小鼠模型中引发恶病质。但令人吃惊的是,这对动物的组织消瘦没有任何改善,这表明一种不同的机制在起作用。因此,这些研究人员决定研究T细胞是否可能发挥作用,这是因为已知它们在小鼠中会促进与小鼠LCMV感染相关的病理出现。令他们吃惊的是,他们发现,当他们在LCMV感染前几天注射破坏杀伤性T细胞的抗体时,他们能够阻止这些小鼠体重减轻:相比于未受感染的健康小鼠,杀伤性T细胞已被剔除的小鼠显示出很少甚至没有体重减轻。Baazim回想道,"这是最令人吃惊的方面之一",这是因为杀伤性T细胞---也称为CD8+ T细胞---在此之前并未发现与恶病质有关。
进一步的实验显示杀伤性T细胞需要被LCMV病毒激活以触发恶病质,而且它们还需要被特定的抗病毒细胞因子激活。然而,目前还不清楚杀伤性T细胞究竟如何促进恶病质产生。 Bergthaler说,他认为这些T细胞可能正在释放一种可溶性因子来指导脂肪组织开始燃烧脂肪,或者它们首先通过另一种类型的细胞传递这种信息。他说,"这是我们留下的重大问题之一。我们知道T细胞在起作用,但我们不知道它们是如何起作用的。"就目前而言,T细胞在促进恶病质产生中的作用似乎仅限于LCMV感染。当这些研究人员用流感病毒重复一些实验时,他们发现T细胞似乎没有引发恶病质。Bergthaler团队当前正在探索这种机制是否能够阻止其他的病毒感染。
美国威尔康奈尔医学院内分泌学家Marcus Goncalves实验室的博士后研究员Ezequiel Dantas(未参与这项新的研究)指出,对癌症相关恶病质的研究主要集中在细胞因子上,比如IL-1、IL-6和TNFα。然而,旨在阻断这些细胞因子的临床干预尚未显示成功---"这意味着我们尚未了解全部情况",Dantas说。对他而言,这项新的研究表明恶病质可能是通过科学家们尚未了解的其他机制发生的。Dantas补充道,"他们正在描述一种以前尚未探索过的全新体重减轻途径。"
斯旺西大学(Swansea University)学者的一项最新研究表明,在细胞水平上控制新陈代谢可能有助于缓解或治愈一系列疾病。该大学医学院的研究人员在《Nature Communications》杂志上发表了他们的研究成果,他们研究了免疫系统细胞在实验室被激活时如何利用它们的代谢途径。免疫系统细胞对抗击感染和预防癌症等疾病至关重要。
当这些被称为CD4+ T细胞的感染细胞和抗癌细胞受到挑战时,它们会产生足够的能量来支持其重要的细胞功能,并创造生物合成的组分来分裂和增殖,以应对感染等挑战。研究人员发现,这些细胞通过吸收营养物质并通过细胞代谢途径来处理这些营养物质。当细胞被激活时,它们会重新改变自己的代谢途径,以提供能量和构建细胞功能所需的基本组分。
图片来源:Cell
领导这项研究的斯旺西大学医学院的Nick Jones博士说:"了解这些细胞是如何代谢的很重要,因为这可能会带来新的疗法,帮助治疗传染病和癌症。"在这项研究中,我们仔细研究了免疫细胞所使用的代谢途径,以及一种特定类型的细胞代谢是如何使它们实现这些重要功能的。我们的研究结果表明,控制新陈代谢可能有助于对抗各种疾病或失调。
在最近一项研究中,研究团队首次记录了长期怀疑的"X细胞"的存在,这类免疫细胞可能在1型糖尿病的发展中起关键作用。相关结果最近发表在《Cell》杂志上。"我们的研究结果不仅表明X细胞存在,而且有强有力的证据表明它是导致1型糖尿病的自身免疫反应的主要驱动因素。我们发现的新型细胞的独特之处在于它可以同时充当B细胞和T细胞。这可能会加剧自身免疫反应,因为一个淋巴细胞同时发挥通常需要两个协同作用的功能。"
辅助T细胞能够激活未成熟的B细胞,以使它们成熟分化为浆细胞,其产生抗体以从体内去除异物或记忆细胞以更快地"记住"抗原的生物化学应对未来的入侵。另一方面,由于未成熟的T细胞与抗原的初始接触,杀伤细胞或细胞毒性T细胞直接攻击它们已被引发的入侵者。然而,当这个过程变得混乱时,B细胞和T细胞寻找并攻击正常细胞,从而诱发自体免疫反应。对于1型糖尿病,科学家一直认为免疫系统会以某种方式混淆并将胰岛素视为目标。因此,被误导的细胞防御力量对产生激素的胰腺中的β细胞发动战争,大大降低可用量并导致糖尿病特征性的高血糖水平。
"人们普遍认为胰岛素被T细胞视为抗原,当胰岛素与APC识别并结合时,就会发生这种情况。然而,我们的实验表明它是一种弱结合,不太可能引发导致1型糖尿病的强烈免疫反应。"相反,新研究的结果表明,当第二种蛋白质 - 由X细胞上存在的BCR编码的蛋白质 - 取代胰岛素时,它结合得更加紧密,以至于它可以引发强度高10,000倍的T细胞反应。
来自德克萨斯大学奥斯汀分校的免疫学家第一次拍摄到了T细胞 早期接受"教育"的视频。相关结果发表在最近的"自然通讯"杂志上。该研究描述了一种允许视频录制的新成像技术,研究结果有望对抗1型糖尿病等自身免疫性疾病。
该研究的作者之一,Lauren Ehrlich副教授说:"T细胞具有识别和抵抗我们生命中遇到的所有不同病原体的任务,但同时需要避免攻击我们自己的健康组织。" "这些细胞在胸腺中成熟,在那里他们受到"教育",因此不会攻击身体健康组织器官。"
Ehrlich和博士后研究员Jessica Lancaster在小鼠胸腺中捕获了这一"教育"过程的视频。使用一对强力激光,以短脉冲激发并每隔15秒扫描一片活组织,重建细胞的位置,运动和细胞内信号,他们观察到随着T细胞的发育,胸腺中的其他细胞帮助它们进行早期的"认知"教育,以后,T细胞需要学会避免攻击身体的健康部位。
Ehrlich说,使用这种新的成像技术研究T细胞有望改善人类健康。例如,接受骨髓移植的患者持续数周或数月,免疫系统受到抑制,发生自身免疫性疾病的风险更高,1型糖尿病患者的T细胞经常攻击产生胰岛素的胰腺细胞。
虽然利用免疫系统对抗癌症的疗法在对抗某些类型的肿瘤方面取得了显着的进展,但它们对大多数癌症患者仍然无效。麻省总医院(MGH)免疫与炎症疾病中心(CIID)的一项新研究描述了一种方法,将通常抑制免疫反应的调节性T细胞重新编程为炎症细胞,不仅允许而且加强了抗肿瘤免疫反应。相关研究成果于近日发表在《Nature》杂志上。
MGH研究的重点是CBM复合物--免疫细胞内的一种大型蛋白簇,有助于调节它们的活化、增殖和功能。最近的研究揭示了CBM复合物在淋巴细胞功能中的一个关键作用,目前已经知道由于删除三个关键蛋白中的一个(CARMA1)会降低效应T细胞的功能,研究小组检测了CARMA1缺失对Treg细胞的影响。他们的实验显示,靶向CBM复合物(无论是通过删除Treg细胞的一个或两个拷贝CARMA1基因或用药物抑制MALT1--复合物的另一个组分)都可以引起肿瘤组织Treg细胞分泌免疫刺激性细胞因子干扰素γ。能够选择性地调节Treg在肿瘤中的功能,可以避免系统性Treg缺失导致自身免疫性疾病的风险。
CBM靶向导致肿瘤组织炎症,细胞毒性CD8 T细胞和自然杀伤细胞浸润增加。但它只是降低了黑色素瘤和结肠癌小鼠模型的肿瘤生长速度,因为这些免疫细胞的活性仍然受到免疫检查点蛋白PD-1的限制。然而,用抗体阻断PD-1的活性可以消除因抗CBM治疗而发炎的肿瘤。"Treg细胞更倾向于'自我反应',这意味着它们对我们自己的'自我'组织抗原做出反应,"哈佛医学院(Harvard Medical School)医学副教授Mempel解释说。"通过对肿瘤组织中的Treg细胞进行重新编程,我们创造了一种局部炎症性自身免疫反应,为肿瘤的免疫治疗做好准备。因此,我们现在可以利用它们的自我反应性来治疗癌症,而不是试图摆脱Treg细胞。"
Mempel博士实验室的Mauro Di Pilato博士研究员、该研究的第一作者补充道:"现在我们需要评估这种方法是否同样适用于人类和理解为什么通过靶向CBM复合物重编程的细胞室是肿瘤环境中而非其他地方的Treg细胞。对Treg细胞进行重新编程可以改善患者对免疫检查点抑制剂的反应,这种能力有可能增加可以通过免疫检查点抑制剂治疗得到帮助的患者数量。"
在一项新的研究中,来自日本德岛大学的研究人员证实CD80与抗原呈递细胞(APC)表面上的PD-L1发生顺式相互作用,从而破坏PD-L1/PD-1结合。随后,当APC表达大量的CD80时,PD-L1不能够与PD-1结合来抑制T细胞激活。通过使用PD-L1/CD80顺式相互作用不能发生的基因敲入小鼠,肿瘤免疫反应和自身免疫反应极大地受到PD-1的减弱。这些发现表明APC表面上的CD80限制PD-1共抑制信号,同时促进CD28介导的共刺激,因而这突出表明了诱导最佳免疫反应的关键组分。相关研究结果发表在Science期刊上。
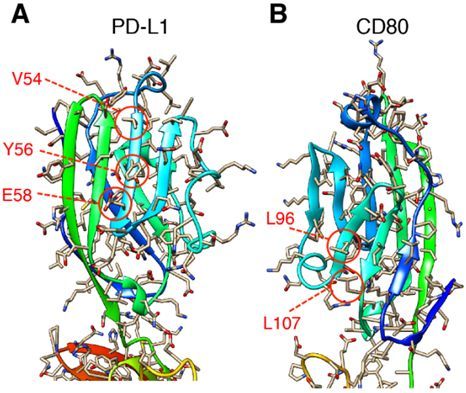
图片来源:Science
在这项新的研究中,这些研究人员证实CD80与相同APC表面上的PD-L1发生顺式相互作用并抑制PD-L1结合PD-1和抑制T细胞激活的能力。尽管如此,这些研究结果并未排除在某些条件下或模型系统中PD-L1和CD80之间可能发生的反式相互作用及其功能。strand-Rosenberg及其同事们已报道CD80在表达PD-L1的肿瘤细胞表面上的过表达减弱了PD-1结合到肿瘤上。基于这一发现,他们提出了应用CD80的可溶性蛋白(CD80-Ig)用于癌症免疫治疗,这是因为CD80-Ig可能通过PD-L1/CD80以及PD-L1/PD-1阻断抑制信号。然而,在这些研究中并未明确PD-L1和CD80之间的相互作用模式,而且CD80和PD-L1在生理条件下的相互作用并未得到证实。近期的另一项研究已报道CD80和PD-L1在同一细胞上的共同过表达导致它们之间发生顺式相互作用,并且在蛋白水平上还观察到PD-1和CD80之间对PD-L1结合的竞争。然而,这种竞争的功能后果并未被探索过,而且它们在生理条件下的相互作用并未得到证实。再者,PD-L1/CD80顺式相互作用在诱导和/或调节免疫反应中的重要性尚不清楚。
在这项新的研究中,这些研究人员报道,在原代树突细胞中,与PD-L1顺式结合的CD80强烈地干扰PD-L1/PD-1结合。此外,他们观察到PD-L1/CD80顺式相互作用强烈地消除了PD-1功能。他们培育出两种基因敲入小鼠品系,在这些小鼠品系中,PD-L1/CD80顺式相互作用受到特异性削弱,而且他们发现在对外源抗原、肿瘤相关抗原和自身抗原作出的免疫反应期间,PD-1功能受到PD-L1/CD80顺式相互作用的持续限制。有趣的是,树突细胞的PD-1结合能力因使用的TLR激动剂不同而受到不同的调节,这表明PD-1可能根据病原体相关的分子模式在不同程度上减轻T细胞对病原体作出的免疫反应。
美国癌症研究所(NCI)癌症研究中心(CCR)的科学家领导的一项研究揭示了促进肿瘤在肿瘤杀伤性免疫细胞存在的条件下持续生长的一种方式,这项发现于近日发表在《Science》上,揭示了一种可以增强抗肿瘤免疫治疗疗法的新方法。死亡的癌细胞会释放出钾离子,而在一些肿瘤中,钾的含量会达到很高的水平。该研究小组报告说,钾的升高会导致T细胞保持干细胞样的质量,或"干细胞性",这与它们在免疫治疗过程中消除癌症的能力密切相关。研究结果表明,增加T细胞对钾的接触--或者模仿高钾的效果--可以使癌症免疫治疗更有效。
"这项研究帮助我们更好地理解为什么癌症免疫疗法会起作用的。"领导该研究小组的CCR研究员Nicholas Restifo博士说道。"这项研究还可以为产生更好、更持久的治疗反应指明道路。"免疫疗法对一些癌症患者产生了显着的效果,根除了难以治疗的肿瘤,在某些情况下,还导致了疾病的完全缓解。但是许多病人的肿瘤对免疫疗法没有反应,研究人员正在努力确定为什么会这样。此外,一些免疫治疗方法,如CAR T细胞和免疫检查点抑制剂,受T细胞寿命的限制。肿瘤内的抗癌T细胞会"耗尽"并死亡。因此,研究人员正在探索帮助用于免疫治疗的T细胞存活更长时间并进行复制和生长的方法。
Restifo博士和他的团队此前曾证实,濒死癌细胞释放到肿瘤内的高水平的钾,可以阻止侵入肿瘤的杀死癌细胞的T细胞。在这项新的研究中,研究人员发现,在高钾条件下生长的T细胞也能保持T细胞的"干性"。这意味着,在肿瘤中,干细胞样T细胞有自我复制的能力,但它们不能成熟为杀伤免疫细胞。通过保持T细胞处于这种状态,肿瘤可以避免攻击并继续生长。这可以解释,为什么肿瘤中存在T细胞,但肿瘤细胞还可以继续生长。然而,当干细胞样T细胞从肿瘤中取出,在实验室中大量生长,然后回到患者体内,干细胞样T细胞可以成熟为能够攻击肿瘤的杀伤细胞。Restifo博士解释说,T细胞保存下来的干性--也就是它们能够无限期地自我更新,并对刺激做出反应,成为抗癌细胞--可能是使过继细胞转移疗法成功的原因。
研究人员接下来探索了用高钾水平来保存T细胞的干细胞以用于治疗的疗效。他们发现,生长在高钾环境下的T细胞可以更有效地抑制移植到小鼠体内的原发性黑色素瘤和转移性黑色素瘤。他们还发现,当暴露于高浓度的钾时,从病人肿瘤中分离出来的T细胞和基因工程抗癌T细胞都具有更高水平的与持续生长和改善免疫治疗结果相关的标志物。最后,研究团队证明,当他们使用特定的药物来模拟钾对小鼠T细胞的影响时,可以提高T细胞继续生长和消除肿瘤的能力。这意味着这种药物可能被用于诱导T细胞的干性,作为增强癌症免疫治疗的一种策略。Restifo博士说,下一步将是临床试验,"利用这些知识来进行更好的治疗",但他也对这些发现有助于我们目前对免疫疗法的理解感到兴奋。
近日来自莫菲特癌症中心的研究人员发现了一种机制,一种名为CD8+T细胞的免疫细胞的功能会由于这种机制而失调,从而阻碍其寻找和杀死癌细胞的能力。"大多数癌症患者T细胞功能受损是癌细胞逃避保护性抗肿瘤免疫的主要原因,也是发展新免疫疗法的一大局限。"莫菲特免疫学系助理教授Paulo Rodriguez博士说道。在这项发表于《Nature Communications》杂志上的新研究中,莫菲特的科学家们调查了免疫系统的功能如何失调,希望更好地理解这些机制,从而能够改善治疗策略。以往的研究表明,蛋白质Chop参与了细胞应激反应和髓样免疫细胞反应。莫菲特的团队想要确定Chop是否也在T细胞免疫中起作用。
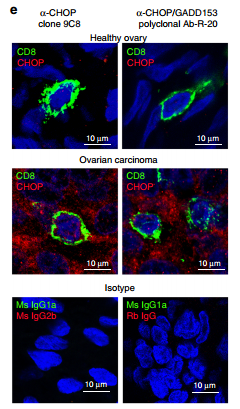
图片来源:Nat Commun
他们发现卵巢癌患者的T细胞中Chop的表达高于正常卵巢组织。他们还发现,卵巢癌患者CD8+肿瘤浸润T细胞中Chop的核水平高与临床反应差有关。这表明Chop可能参与了癌症免疫反应的改变。
为了确定Chop在T细胞中的功能,研究人员对小鼠、原代小鼠和人类T细胞进行了大量的实验室实验。他们发现Chop在负向调节T细胞反应中起着重要作用,当T细胞被激活时,Chop水平会增加。这种增加依赖于与压力反应有关的蛋白质Perk。当研究人员删除T细胞中的Chop基因后,抗肿瘤CD8+ T细胞免疫功能得到提高,研究人员发现在免疫相关的小鼠模型中,基于T细胞的免疫治疗更有效。
这些观察表明,在正常情况下,Chop在帮助平衡抗肿瘤T细胞反应中发挥重要作用。然而,肿瘤已经学会了劫持Chop的正常功能来降低T细胞免疫。而更不活跃的免疫系统允许癌细胞避开T细胞的抗肿瘤免疫功能,导致癌细胞继续生长和发育。
近日来自伦敦大学学院和新加坡A*STAR的研究人员试图联合这两种方法,利用各自的优点去治疗HCC,他们通过下调病毒性肿瘤抗原特异性的T细胞的PD-1信号通路来克服T细胞耗竭的问题,相关研究成果发表在《Molecular Recalibration of PD-1+ Antigen-Specific T Cells from Blood and Liver》上。
研究人员开发了一种新的慢病毒转染方法,可以优先靶向内源性或TCR重排的抗原特异性CD8 T细胞,利用shRNA敲除其PD-1,随后检测了这种T细胞的抗癌效果。研究人员发现和对照组慢病毒载体相比,利用慢病毒-shPD-1进行抗原特异性的肝内CD8 T细胞转染可以显着降低其PD-1的表达。
敲低人T细胞中的PD-1可以恢复T细胞的抗癌效应功能,可以促进其在模拟高表达PD-L1的炎前肝脏微环境的3D微设备中杀伤癌细胞的能力。但是一旦反复刺激,PD-1的敲低就会导致T细胞的衰老,同时引发其他共刺激信号通路。
这项研究表明慢病毒可以靶向遗传工程化的特异性靶向HBV相关HCC病毒抗原的T细胞,实现功能性基因编辑。而敲低PD-1可以短时间内增强T细胞杀伤肿瘤细胞的能力,但是由于存在其他补偿性共刺激信号以及反复刺激会导致T细胞衰老,因此这种方法的效果仍然很有限。
林斯顿的一个团队使用数学建模提供了对这个问题的见解。研究小组发现,T细胞如何扩张的最重要因素是感染因子的起始量和细胞对该药物的亲和力。该研究有助于优化疫苗策略,该研究发表在《PNAS》杂志上。
在新感染的早期,抗原呈递细胞在其表面显示出大量抗原,但随着时间的推移,这种表现逐渐减弱,特别是如果免疫系统成功地进行了感染。研究小组发现,这些抗原水平的降低提供了一种简单的机制,可以解释幂律关系。这个想法是T细胞以其最大速率扩增,直到抗原数量减少意味着T细胞不再能够找到抗原。
"如果你开始使用较少数量的T细胞,你可以进行更长时间的扩增,直到达到降低的抗原水平,"Mayer说。 "但如果你开始使用更多的T细胞,那么相对较快的抗原就会耗尽。"无法找到抗原的T细胞最终会停止分裂。
Wingreen说,这种关系具有进化意义,因为当感染消失时,T细胞就会停止扩张,从而使免疫系统变得过度活跃。研究小组还研究了T细胞和抗原呈递细胞之间关系的另一个方面:两者相互作用的强度。他们的模型预测强烈粘附于抗原的细胞会增殖更长时间:对抗原的亲和力越高,最终细胞数量越大。研究人员能够通过重新分析另一项先前发表的研究的数据来检查这一预测。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


